
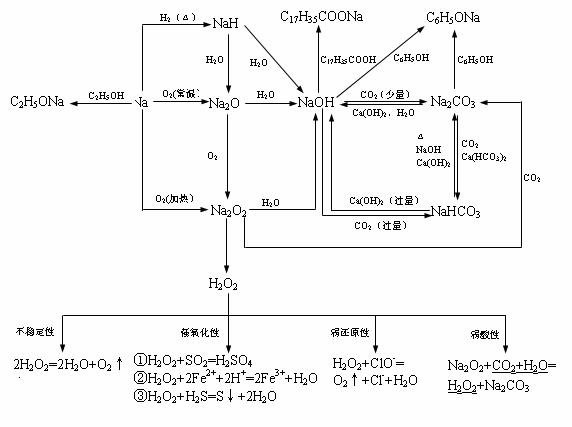
3.特殊的反应现象
|
燃 烧 |
H2+Cl2(苍白色火焰),C2H2(C6H6)+O2(明亮火焰,浓烈黑烟)。 |
|
焰色反应 |
Na+(黄色)、K+(紫色)。 |
|
淀粉遇I2变蓝,蛋白质遇浓硝酸变黄。 |
|
|
使湿润的红色石蕊试纸变蓝 |
NH3 |
|
使品红溶液褪色 |
SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。 |
|
在空气中由无色变为红棕色的气体 |
NO |
|
Fe3+遇OH-生成红褐色沉淀,遇苯酚显紫色,遇SCN-显红色。 |
|
|
Fe2+遇OH-生成白色沉淀,并迅速变成灰绿色,最后生成红褐色;Fe2+遇SCN-无明显变化,通入Cl2后溶液显红色。 |
|
|
与强碱溶液反应产生气体的溶液一般含NH4+ |
|
|
与酸反应产生气体的溶液一般可能含:CO32-、HCO3-、SO32-、HSO3-(S2-、HS-)等 |
2.物质的特征结构
|
10电子微粒可能为 |
N3-、O2-、F-、OH-、NH2-、Ne、CH4、NH3、H2O、HF、Na+、Mg2+、Al3+、NH4+、H3O+等。 |
|
18电子微粒可能为 |
K+、Ca2+、Ar、F2、SiH4、PH3、H2S、HCl、H2O2、N2H4
CH3CH3 CH3F CH3OH HS-、S2-、Cl-、O22-等。 |
|
14电子微粒可能为 |
CO、N2
、C22- |
|
常见的正四面体结构有 |
甲烷、CCl4、白磷、NH4+;三角锥形有NH3;直线型的多原子分子可能为CO2。 |
|
H的原子核内没有中子。 |
|
|
常见元素中半径最小的是H。 |
|
|
最外层电子数等于电子层数的元素有 |
H、Be、Al、Ge等。 |
|
最外层电子数是次外层电子数2倍或3倍的元素一定在第二周期 |
|
|
常见的原子晶体单质是 |
金刚石和晶体硅 |
1.颜色状态
|
状态 |
常温下呈液态的特殊物质: H2O、H2O2、C6H6
、 C2H6O
、Br2、Hg、等 |
|||
|
颜色 |
有色气体:NO2
(红棕色)、F2(浅黄绿色)、Cl2(黄绿色);无色刺激性气体:SO2、NH3、HX(F、Cl、Br、I);无色无味气体:H2、N2、O2、CO2、CO、CH4、C2H2、NO。 |
溶液中的有色离子:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、MnO4-[紫(红)色]。Br2在水中显黄(橙)色,在有机溶剂中显橙(红)色,I2在水中显黄(褐)色,在有机溶剂中显紫(红)色。 |
有色固体:(淡)黄(棕)色固体:Na2O2、S、FeS2、FeCl3;黑色固体:MnO2、C、CuO、FeO、Fe3O4、CuS CuS2 ;紫(黑)色固体:KMnO4、I2;(紫)红色固体:Cu Fe2O3Cu2O
e(OH)3 Cu;蓝(绿)色固体:Cu(OH)2CuSO4·5H2O。 |
有色沉淀:①白色沉淀:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Fe(OH)2、Al(OH)3、BaCO3、CaCO3、CaSO3、MgCO3等;②(浅)黄色沉淀:AgBr、AgI、S;③红褐色沉淀:Fe(OH)3;④蓝色沉淀:Cu(OH)2;⑤黑色沉淀:CuS、FeS。 |
3. 培养学生的思维能力和综合解题能力21世纪教育网
[教法指引]
读题(了解大意)→审题(寻找明显条件、挖掘隐含条件与所求)→解题(抓突破口)→推断(紧扣特征与特殊)→得出结论→正向求证检验
读题:读题的主要任务是先了解题目大意,寻找关键词、句,获取表象信息。切勿看到一点熟悉的背景资料就匆匆答题,轻易下结论,这样很容易落入高考试题中所设的陷阱。
审题:对读题所获信息提炼、加工,寻找明显的或潜在的突破口,更要注意挖掘隐含信息-“题眼”。“题眼”常是一些特殊的结构、状态、颜色,特殊的反应、反应现象、反应条件和用途等等。审题最关键的就是找出”题眼”21世纪教育网
解题:找到“题眼”后,就是选择合适的解题方法。解无机推断题常用的方法有:顺推法、逆推法、综合推理法、假设法、计算法、实验法等。通常的思维模式是根据信息,大胆猜想,然后通过试探,验证猜想;试探受阻,重新阔整思路,作出新的假设,进行验证。一般来说,先考虑常见的规律性的知识,再考虑不常见的特殊性的知识,二者缺一不可。
验证:不论用哪种方法推出结论,都应把推出的物质代入验证。如果与题设完全吻合,则说明我们的结论是正确的。最后得到正确结论时还要注意按题目要求规范书写,如要求写名称就不要写化学式
[知识网络]
解答无机推断题需要一定的背景知识为基础。下面以“考纲”为核心,以教材出发,结合对近几年高考试题的分析和对未来的预测,对常考的热点知识作如下归纳:
2. 掌握元素化合物间相互转化关系
1. 掌握无机元素化合物基础知识和基本理论、基本概念

(1)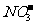 与Fe2+在酸性条件下,不能共存。
与Fe2+在酸性条件下,不能共存。
(2)过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
(3)注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体21世纪教育网
(4)注意亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
(5)注意铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+21世纪教育网
21世纪教育网
(1)注意钠及其化合物溶于水所得溶液浓度的计算中,Na及Na2O2溶于水均会产生气态物质,所得溶液的质量应是原混合物质的质量总和减去产生气体的质量。
(2)注意Na2O2跟CO2和水蒸气组成的混合气体反应时的先后顺序。若先发生反应:2 Na2O2+2H2O=4NaOH+O2↑,必还发生2NaOH+ CO2=Na2CO3+H2O,即应先考虑Na2O2跟CO2的反应21世纪教育网
(3)正确理解“焰色反应”:
①它是元素的一种物质性质。无论是金属离子或金属原子均能发生焰色反应。它属物理变化过程。
②不是所有元素都有特征的焰色。只有碱金属元素以及钙、锶、钡、铜等少数金属元素才能呈现焰色反应21世纪教育网
③焰色反应的显色过程与气体物质燃烧时产生各色火焰的过程有着本质的区别。焰色反应并非金属及其化合物自身发生燃烧反应而产生各种颜色火焰的过程,而是它们的原子或离子的外围电子被激发而产生的各种颜色的光的过程。
1、镁铝及其化合物
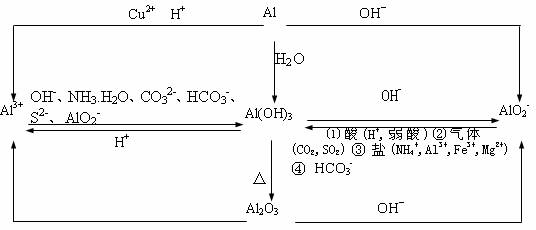
(1)镁是活泼金属,虽不跟碱性溶液反应,但能置换出酸中的氢,也能与水解呈酸性的盐溶液反应产生H2。
(2)注意对Al2O3、Al(OH)3两性的理解,以及对Al3+、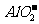 存在条件的认识。
存在条件的认识。
Al2O3、Al(OH)3仅能溶于强酸和强碱溶液中(如在氨水和碳酸中均不溶),Al3+、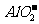 只能分别存在于酸性与碱性溶液中21世纪教育网
只能分别存在于酸性与碱性溶液中21世纪教育网
Al3+与下列离子不能大量共存: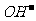 、
、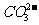 、
、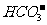 、
、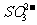 、
、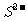 、
、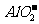 ,其中
,其中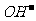 是因为直接反应,其余均是“双水解”21世纪教育网
是因为直接反应,其余均是“双水解”21世纪教育网
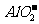 与下列离子不能大量共存:H+、
与下列离子不能大量共存:H+、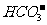 、NH4+、Al3+、Mg2+、Cu2+。其中H+和
、NH4+、Al3+、Mg2+、Cu2+。其中H+和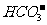 是因为直接反应(
是因为直接反应(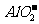 +
+ 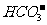 +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+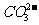 ),其余也是“双水解”。
),其余也是“双水解”。
(3)注意正确理解图象的涵义21世纪教育网
图示中每个曲线或每条曲线的转折点(拐点),都反映了特定的反应,若没有找对,或对生成沉淀和沉淀溶解所需加入(或通入)溶液(或气体)的量之比没搞清,易导致错误。
注意研究以下几个实验现象及产生沉淀的量与加入物质的量的数量关系的图象:
①向AlCl3溶液中逐滴加入NaOH溶液直至过量;②向AlCl3和MgCl2混合中逐滴加入NaOH溶液直至过量;④向HCl、MgCl2、AlCl3混合液中逐滴加入NaOH溶液直至过量;③向NaAlO2溶液中逐滴加入HCl溶液直至过量;⑤向HCl溶液中逐滴加入NaAlO2溶液直至过量。
这些是以化学知识为载体考查学生的综合能力的重要的命题内容,认真研究一定会有益处21世纪教育网
(4)Mg(OH)2的溶解度小于MgCO3。所以在碱性溶液中Mg2+总是转化为Mg(OH)2沉淀,产生的MgCO3也会在加热的条件下逐渐转化为Mg(OH)2[MgCO3+H2O(沸水)=Mg(OH)2+CO2↑]。
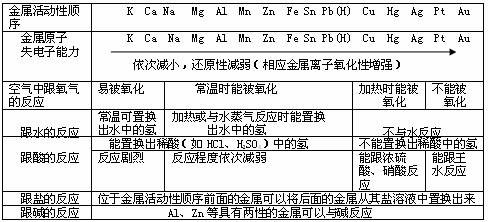
7、金属活动性顺序表应用小结
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com