
1、基和根的比较
(1) “基”指的是非电解质(如有机物)分子失去原子或原子团后残留的部分。
(2)“根”指的是电解质由于电子转移而解离成的部分。如:OH-、CH3+、NH4+等.
两者区别:基中含有孤电子,不显电性,不能单独稳定存在;根中一般不含孤电子,显电性,大多数在溶液中或熔化状态下能稳定存在。
12.与工业生产相关的主要反应
|
工业制漂白粉 |
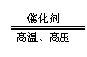  2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O 2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O |
|
工业合成氨 |
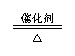 N2+3H2 2NH3 N2+3H2 2NH3 |
|
氨的催化氧化 |
 4NH3+5O2 4NO+6H2O 4NH3+5O2 4NO+6H2O |
|
电解饱和食盐水 |
2NaCl+2H2O 2NaOH+H2↑+Cl2↑ |
|
电解制镁、铝 |
  MgCl2 Mg+Cl2↑;2Al2O3 4Al+3O2↑ MgCl2 Mg+Cl2↑;2Al2O3 4Al+3O2↑ |
|
工业制玻璃 |
  Na2CO3+SiO2 Na2SiO3+CO2↑; Na2CO3+SiO2 Na2SiO3+CO2↑;  CaCO3+SiO2 CaSiO3+CO2↑ CaCO3+SiO2 CaSiO3+CO2↑ |
|
工业制硫酸 |
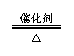 4FeS2+11O2 2Fe2O3+8SO2(或S+O2 SO2); 4FeS2+11O2 2Fe2O3+8SO2(或S+O2 SO2);  2SO2+O2 2SO3;SO3+H2O H2SO4 2SO2+O2 2SO3;SO3+H2O H2SO4 |
|
工业制粗硅 |
SiO2+2C Si+2CO↑ |
21世纪教育网
11.物质间的一些特殊转化关系
物质间的转化关系是解无机推断题的精髓,除了熟记一般的转化网络如“铝三角”、“铁三角”等外,还要了解一些特殊的转化关系,例如:
 H2 HCl
HNO3 H2 HCl
HNO3H2O H2O H2O O2 Na2O NaOH |
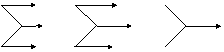 Na Na2O NaOH Na Na2O NaOHNaCl NaCl NaCl Cl2 HCl MgCl2 |
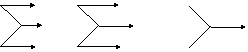 Mg MgO
MgSO4 Mg MgO
MgSO4 MgCl2 MgCl2 MgCl2(或把Mg换成Cu) Cl2 HCl BaCl2 |
10.物质组成的特殊配比
能形成原子个数比为2:1或1:1的特殊化合物有:Na2O、Na2O2类,H2O、H2O2类,CaC2、C2H4、C2H2、C6H6类21世纪教育网
9.化合价变化
变价元素结合氧化还原反应是推断题的命题角度之一,常考到的元素有:Cl、S、N、C、Fe等21世纪教育网
8.与碱反应产生气体
⑴
⑵铵盐: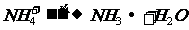
7.
 特殊的反应条件
特殊的反应条件
|
放电 |
N2+O2 2NO;3O2 2O3 |
|
光照 |
H2+Cl
2HCl; 2HClO 2HCl+O2↑
; 4HNO3 4NO2↑+O2↑+2H2O |
|
催化剂 |
2H2O2 2H2O+O2↑ 2KClO3 2KCl+3O2↑;2SO2+O2 2SO3; N2+3H2 2NH3; 2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CH2OH +O2  2CH3COOH 2CH3COOHCH3COOH+CH3CH2OH 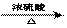 CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O |
6.分步氧化的几种情况
|
分步氧化的几种情况 |
在中学化学中,常见的分步氧化如下: A B C |
|
1、掌握一些特别的连续变化关系 (1) 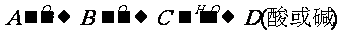 ① 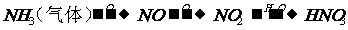 ② 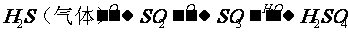 ③ 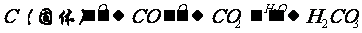 ④ 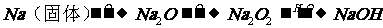 (2)A- 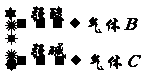 A为弱酸的铵盐:(NH4)2CO3或NH4HCO3 ;(NH4)2S或NH4HS;(NH4)2SO3、NH4HSO3 |
|
|
2. NH3 NO NO2 |
|
|
3. N2 NO NO2 |
|
|
4.C CO CO2 |
|
|
5. Na Na2O Na2O2 |
|
|
6.RCH2OH RCHO RCOOH |
5.置换反应的类型
|
置换反应的类型 |
1.金属→金属 如 Fe +Cu2+ Fe2++Cu, 2Al+Fe2O3 Al2O3+2Fe |
|
2.金属→非金属(1)固态金属气态非金属 如:Zn+2H+ Zn2++H2↑,2Na+2 H2O 2NaOH+H2↑, 3Fe+4H2O(g) △ Fe3O4+4H2 (2)固态金属→固态非金属如:2Mg+CO2 2MgO+C |
|
|
3.非金属→非金属(1)固态非金属→固态非金属 如:2C+SiO2 Si+2CO↑ (2)固态非金属→气态非金属如:C+ H2O(g) CO+ H2 (3)气态非金属→固态非金属 如:Cl2+2KI 2KCl+I2, Cl2+H2S 2HCl+S↓ O2+4HI 2I2+ H2O (4) 气态非金属→气态非金属如:2F2+2H2O 4HF+O2 (5)气态非金属→液态非金属如:Cl2+2HBr 2HCl+Br2 |
|
|
4. 非金属→金属 如:C+CuO Cu+CO↑,3H2+Fe2O3 2Fe+3H2O |
4.特征反应(中学)
|
既能与强酸溶液反应又能与强碱溶液反应的物质 |
(1)金属单质:Al |
|
(2)两性物质:两性氧化物如Al2O3,两性氢氧化物如Al(OH)3、氨基酸等。 |
|
|
(3)弱酸弱碱盐:如(NH4)2CO3、CH3COONH4等。 |
|
|
(4)弱酸的酸式盐:如NaHCO3、Ca(HCO3)2、AaHSO3等 |
|
|
固体加热后不留残渣的物质 |
I2、NH4Cl、(NH4)2CO3、NH4HCO3。 |
|
常温与水反应产生气体的物质 |
Na、K、F2、Na2O2、CaC2。 |
|
有MnO2参与的化学反应 |
 (1)2H2O2 MnO2 2H2O+O2↑ (1)2H2O2 MnO2 2H2O+O2↑ |
 (2)2KClO3
2KCl+3O2↑ (2)2KClO3
2KCl+3O2↑ |
|
 (3)MnO2+4HCl(浓) △
MnCl2+2H2O+Cl2↑ (3)MnO2+4HCl(浓) △
MnCl2+2H2O+Cl2↑ |
|
|
一种物质反应生成三种物质 |
 2KmnO4
△ K2MnO4+MnO2+O2↑ 2KmnO4
△ K2MnO4+MnO2+O2↑ |
 2NaHCO3 △ Na2CO3+H2O+CO2↑ 2NaHCO3 △ Na2CO3+H2O+CO2↑ |
|
 Ca(HCO3)2 △ CaCO3+H2O+CO2↑ Ca(HCO3)2 △ CaCO3+H2O+CO2↑ |
|
 NH4HCO3 △ NH3↑+H2O↑+CO2↑ NH4HCO3 △ NH3↑+H2O↑+CO2↑ |
|
 (NH4)2CO3 △
2NH3↑+H2O↑+CO2↑ (NH4)2CO3 △
2NH3↑+H2O↑+CO2↑ |
|
 4HNO3 H2O+4NO2↑+O2↑ 4HNO3 H2O+4NO2↑+O2↑ |
|
|
两种物质反应生成三种物质 |
铵盐与碱反应,如NH4Cl与Ca(OH)2 |
|
Cu、C等与浓H2SO4或硝酸的反应 |
|
|
Na2CO3、NaHCO3、Na2SO3、NaHSO3等与强酸反应。 |
|
|
电解饱和NaCl溶液、CuSO4溶液、AgNO3溶液等。 |
|
|
Cl2 与NaOH[Ca(OH)2]反应 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com