
(2)步骤:
①计算:计算所需固体溶质质量或液体溶质的体积。
②用托盘天平称量固体溶质或用量筒量取液体体积。
③溶解:将溶质加入小烧杯中,加适量水溶解。
④移液洗涤:将已溶解而且冷却的溶液转移到容量瓶中,并用玻璃棒引流,再洗涤烧杯和玻璃棒2-3次,将洗涤液倒入容量瓶中。
⑤定容:缓缓向容量瓶中注入蒸馏水,直到容量瓶液面接近刻度线1cm-2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切,盖好,反复上下颠倒,摇匀。最后将容量 瓶中溶液转移到试剂瓶中备用21世纪教育网
21世纪教育网
(1)气体摩尔体积的计算
对标准状况下的气体有n=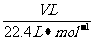
(2)确定气体的分子组成
一般思路是:根据阿伏加德罗定律,由体积比推导出粒子、分子个数比,再根据质量守恒定律确定化学式。如2体积气体Ax与1体积气体By恰好完全反应生成2体积A2B,由阿伏加德罗定律可知:气体的分子数之比等于其体积比,即Ax∶By∶A2B=2∶1∶2,所以两气体反应物为双原子分子,即A2和B2。
(3)气体的相对分子质量的计算方法
①已知标准状况下气体密度ρ,M=ρ·22.4 L·mol-1,Mr=M g·mol-1。
②根据阿伏加德罗定律计算: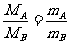 (同T、p、V)。
(同T、p、V)。
2.c、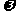 %、ρ之间的计算关系
%、ρ之间的计算关系
(1)计算关系: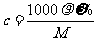
(2)使用范围:同一种溶液的质量分数与物质的量浓度之间的换算
(3)推断方法:①根据物质的量浓度的定义表达式
②溶质的物质的量用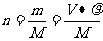 计算
计算
③注意溶液体积的单位
1.物质的量与其他化学常用计量间的相互求算,是重要的基本化学计算。其解题关键是熟练掌握下列恒等式:
n=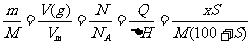 =c·V(aq)
=c·V(aq)
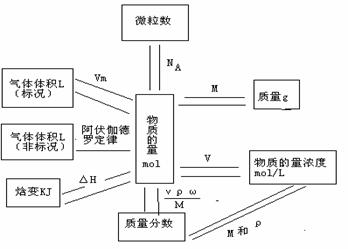
式中n为物质的量,单位为mol;m为物质质量,单位为g;M为摩尔质量,单位为g·mol-1; V(g)为气体体积,单位为L;Vm为标准状况下气体摩尔体积,单位为L·mol-1;N为粒子个数;NA为阿伏加德罗常数6.02×1023mol-1;Q为物质的反应热,单位为J或kJ;ΔH为摩尔反应热,单位为kJ·mol-1;c为物质的量浓度,单位为mol·L-1;V(aq)为溶液体积,单位为L;x为饱和溶液的质量,单位为g;S为溶解度,单位为g21世纪教育网
阿伏加德罗常数问题主要有:
(1)一定质量的物质中所含原子数、电子数,其中考查较多的是H2O、N2、O2、H2、NH3、P4等。
(2)一定体积的物质中所含原子数、分子数,曾考过的物质有Cl2、NH3、CH4、O2、N2、CCl4、C8H10等21世纪教育网
(3)一定量的物质在化学反应中的电子转移数目,曾考过的有Na、Mg、Cu等。
(4)一定体积和一定物质的量浓度溶液中所含电解质离子数、分子数,如稀硫酸、硝酸?镁等。
(5)某些典型物质中化学键数目,如SiO2、Si、CH4、P4、CO2等。
(6)细微知识点(易出错):状态问题,水、CCl4、C8H10等在标准状况下为液体或固体;D2O、T2O、18O2等物质的摩尔质量;Ne、O3、白磷等物质分子中原子个数等。
2.物质的量和其它物理量之间的关系:
1. 基本概念和重要定律
(1)常用的物理方法--根据物质物理性质上的差异选择分离与提纯方法。有过滤、蒸发结晶、降温结晶、蒸馏、分馏、萃取、分液、渗析、升华等方法。
(2)常用的化学方法
吸收法--常用于气体的净化和干燥,可根据被提纯气体中所含杂质气体的性质,选择适当的固体或溶液作为吸收剂。如Cl2中混有的HCl气体可通过饱和食盐水除去。常用装置是洗气瓶或干燥管(U形管)。
沉淀法--在被提纯的物质中加入适量试剂使其与杂质反应,生成沉淀过滤除去。如硝酸钾中含有的少量硝酸钡,可用适量的硫酸钾除去。
气体法--根据物质中所含杂质的性质加入合适的试剂,让杂质转化为气体除去。如KCl中混有的少量K2CO3,可加适量盐酸除去。
转化法--利用化学反应,加入适当的试剂或采用某种条件(如加热),使物质中的杂质转化为被提纯物质,以正盐、酸式盐间的转化最为常见。如:NaHCO3 Na2CO3。
Na2CO3。
溶解法--对于固体试剂可选择适当的物质将杂质溶解,然后过滤除去,以杂质为两性物质常见。如Mg(OH)2中混有Al(OH)3,可用过量NaOH溶液除去,然后洗涤Mg(OH)2即可。
(3)综合法
综合法是指综合运用物理方法和化学方法将物质加以分离或提纯。如分离 的
的
混合物:
21世纪教育网
常见物质的检验方法,一方面是根据物质的物理性质(如颜色、溶解性、溶解热效应等)直接检验,另一方面是根据物质化学性质,使被检验物质与加入的试剂作用,产生某种特殊现象(如:生成气体、沉淀,产生特殊颜色等),从而确定该物质的存在。
(1)离子的检验。检验的原理是依据离子的特征反应现象如呈现特殊颜色变化、生成沉淀、生成气体等。十种常见离子的检验方法是:K+、Na+用焰色反应;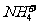 用浓氢氧化钠溶液、加热产生的气体检验;Fe3+用硫氰化钾溶液检验;Al3+用氢氧化钠溶液检验;
用浓氢氧化钠溶液、加热产生的气体检验;Fe3+用硫氰化钾溶液检验;Al3+用氢氧化钠溶液检验;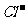 、
、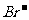 、
、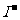 用硝酸银溶液和稀硝酸检验;
用硝酸银溶液和稀硝酸检验;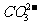 用盐酸和澄清石灰水检验;
用盐酸和澄清石灰水检验;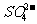 用Ba(NO3)2溶液(或BaCl2溶液)和稀硝酸(或稀盐酸)检验。
用Ba(NO3)2溶液(或BaCl2溶液)和稀硝酸(或稀盐酸)检验。
(2)气体的检验。检验的根据是由气体的特征性质(化学和物理的)所表现的现象。但是注意:有些现象是某几种气体所共有的,如二氧化碳与二氧化硫都能使澄清的石灰水变浑浊,不少可燃性气体(如氢气、一氧化碳、甲烷等)的燃烧,其火焰都呈淡蓝色,当它们混有一定量空气时,点燃都会爆鸣;溴蒸气、氯气、二氧化氮都能使碘化钾淀粉试纸变蓝等等。因此遇到这些情况,不要过早下结论,而要综合考虑性质和现象。
(3)有机物的检验。常用的试剂有:
①高锰酸钾酸性溶液:烯烃、炔烃、苯的同系物、醇、酚、醛、甲酸、甲酸酯、甲酸盐、葡萄糖、麦芽糖等均可使高锰酸钾酸性溶液褪色。
②溴水:烯烃、炔烃、酚、醛、甲酸、甲酸酯、甲酸盐、葡萄糖均可使溴水褪色(加成或氧化反应)。
③银氨溶液:凡含有-CHO的有机物如醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖均可发生银镜反应。
④新制的Cu(OH)2碱性悬浊液:常温下,多羟基的物质如甘油、乙二醇、葡萄糖都能溶解新制的Cu(OH)2?得绛蓝色溶液,羧酸与Cu(OH)2发生中和反应得蓝色溶液。含-CHO的物质与新制Cu(OH)2?碱性悬浊液加热有砖红色 Cu2O沉淀生成?。
⑤FeCl3溶液:与苯酚反应形成紫色溶液。
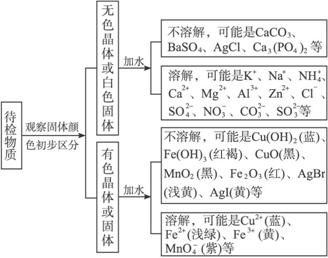
(1)固态物质的检验
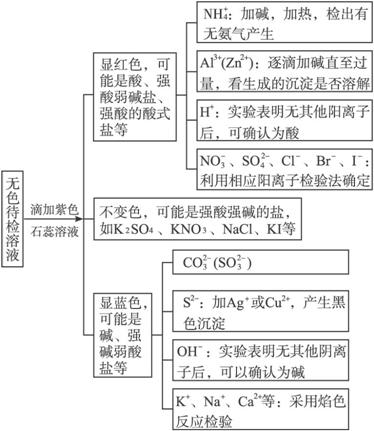
(2)无色溶液的检验
(3)气态物质的检验
由于气体贮存困难,使用时易扩散,故检验中要尽可能使用物理性质加以检验,即使使用化学方法,尽可能多用试纸。可按下列顺序检验:

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com