
4、 离子反应的运用
3、 离子推断和检验
2、 离子方程式的正误判断以及书写
1、 离子共存问题
3. 能正确书写化学方程式和离子方程式,能应用离子的化学性质,书写新情境下的离子方程式。并能进行有关计算。21世纪教育网
[教法指引]
教师在复习此专题时应加强以下几个知识点的教学:
2. 了解离子反应的概念、离子反应发生的条件,了解常见离子的检验方法。
1. 了解电解质的概念,了解强电解质和弱电解质的概念。
2. 性质强弱规律

3. 掌握物质氧化性或还原性强弱的比较
(1)由元素的金属性或非金属性比较 <1>金属阳离子的氧化性随其单质还原性的增强而减弱

非金属阴离子的还原性随其单质的氧化性增强而减弱
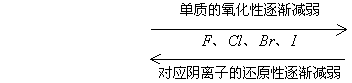
(2)由反应条件的难易比较 不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如:
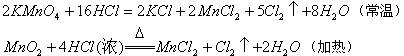
前者比后者容易发生反应,可判断氧化性: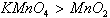 。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
(3)根据被氧化或被还原的程度不同进行比较
当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。如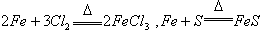 ,根据铁被氧化程度的不同
,根据铁被氧化程度的不同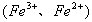 ,可判断氧化性:
,可判断氧化性: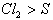 。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强21世纪教育网
。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强21世纪教育网
(4)根据反应方程式进行比较
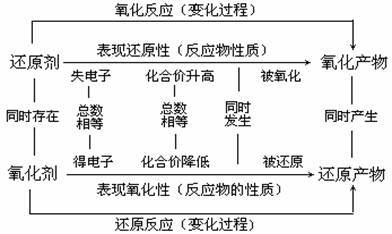
氧化剂+还原剂=还原产物+氧化产物
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物
(5)根据元素周期律进行比较
一般地,氧化性:上>下,右>左;还原性:下>上,左>右。
(6)某些氧化剂的氧化性或还原剂的还原性与下列因素有关:
温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
浓度:如浓硝酸的氧化性比稀硝酸的强。
酸碱性:如中性环境中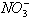 不显氧化性,酸性环境中
不显氧化性,酸性环境中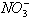 显氧化性;又如
显氧化性;又如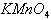 溶液的氧化性随溶液的酸性增强而增强。
溶液的氧化性随溶液的酸性增强而增强。
注意:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性: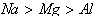 ,氧化性:
,氧化性: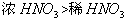 。
。
21世纪教育网
21世纪教育网
1. 了解基本概念
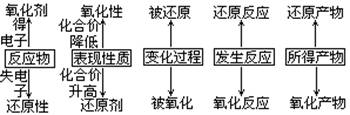
3、 引导学生学会解决有关氧化还原反应的计算方法和技巧;
① 可根据电子守恒,依据氧化剂得电子总数等于还原剂失电子总数的关系,列出守恒关系式求解,从试题的变化趋势看,有一类题目是已知参加反应的氧化剂与还原剂的质量比,计算确定产物。计算公式如下:
氧化剂物质的量×变价元素原子的个数×化合价的变化值=还原剂物质的量×变价元素原子的个数×化合价的变化值
② 要注意参加反应的量不一定完全是被氧化,或被还原;或一种物质由于歧化,有一部分被氧化,而另一部分被还原;即部分氧化或部分还原的计算21世纪教育网
[知识网络]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com