
6、 了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
[教法指引]
本专题是基本理论部分难度较大的一个专题,教师在复习此专题时,应加强如下知识点的教学:
①考查反应速率的简单计算。
②各物质间反应速率的关系;化学反应速率的大小比较。
③根据浓度、温度、压强、催化剂、颗粒大小等外界因素定性判断反应速率的变化。
④ v-t图象的分析,会用反应速率知识解决实际问题,对图象的变化能作出合理的解释。
⑤可逆反应的特点;化学平衡的建立、特征、及标志。
⑥化学平衡与化学反应速率之间的内在联系。
⑦等效平衡。
⑧外界条件对化学平衡的影响。
⑨理解化学平衡和化学平衡常数的含义,能用化学平衡常数计算反应物的转化率。
以上几点都是高考中的重要知识点,我们在教学过程中不能急于求成,要结合学生掌握的情况,及时总结,查漏补缺。对一些薄弱环节还应强化训练,但不能忽略基础知识的再巩固21世纪教育网
[知识网络]
化学反应速率

化学平衡


化学平衡图像的常见类型: 对于反应mA(g)+nB(g)
对于反应mA(g)+nB(g) pC(g)+qD(g) △H
1.转化率-时间关系图:
pC(g)+qD(g) △H
1.转化率-时间关系图:
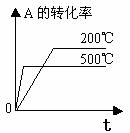
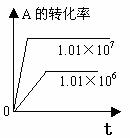
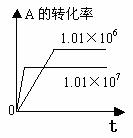
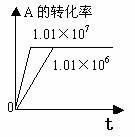
P一定时,△H 0 T一定时,m+n p+q T一定时,m+n p+q T一定时,m+n
p+q
2.含量-时间关系图:
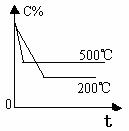
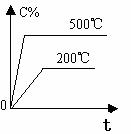
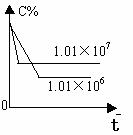
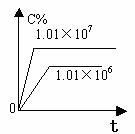 P一定时,△H 0 P一定时,△H 0 T一定时,m+n p+q T一定时,m+n p+q
P一定时,△H 0 P一定时,△H 0 T一定时,m+n p+q T一定时,m+n p+q
5、 理解化学平衡常数并能利用化学平衡常数进行简单计算。
4、 理解浓度、温度、压强等条件对化学平衡移动的影响。
3、 了解化学反应的可逆性。
2、 了解温度、浓度、压强和催化剂影响化学反应速率的一般规律。
1、 了解化学反应速率的概念、反应速率的定量表示方法。
2. 晶体熔沸点比较
⑴不同类型晶体
原子晶体 > 离子晶体 > 分子晶体(金属晶体不一定)
⑵同种类型晶体
离子晶体:化学式及结构相似时,离子的半径越小,离子所带的电荷越多,熔沸点就高
如:KF > KCl > KBr >KI,MgO > NaF
原子晶体:一般同种类型的原子晶体,原子半径越小,共价键键长越短,共价键作用越强,则晶体的熔沸点越高。如:金刚石 > 金刚砂 > 晶体硅。
分子晶体:①组成和结构相似的分子晶体,相对分子质量越大,一般分子间作用力越强,熔沸点越高。如:O2 > N2,HI > HBr > HCl。
②在同分异构体中,一般说,支链越多,对称性越好,熔沸点越低。如正戊烷>异戊烷>新戊烷;邻二甲苯>间二甲苯>对二甲苯
③分子间氢键使物质的熔沸点升高。如:HF > HCl,H2O > H2S,NH3 > PH3,C2H5OH > C4H10。
金属晶体:金属晶体中金属离子半径越小,离子电荷数越多,其金属键越强,金属的熔沸点越高。如:Na < Mg< Al。
21世纪教育网
1.
|
|
离子晶体 |
分子晶体 |
原子晶体 |
金属晶体 |
|
|
结构 |
组成粒子 |
阴、阳离子 |
分子 |
原子 |
金属阳离子和自由电子 |
|
粒子间作用 |
离子键 |
范德瓦耳斯力 |
共价键 |
金属键 |
|
|
物 理 性 质 |
熔沸点 |
较高 |
低 |
很高 |
有高有低 |
|
硬度 |
硬而脆 |
小 |
大 |
有大有小、有延展性 |
|
|
溶解性 |
一般易溶于极性溶剂,难溶于非极性溶剂 |
极性分子易溶于极性溶剂 |
不溶于任何溶剂 |
难溶(钠等与水反应) |
|
|
导电性 |
晶体不导电;能溶于水的其水溶液导电;熔化导电 |
晶体不导电,溶于水后能电离的,其水溶液可导电;熔化不导电 |
不良(半导体Si) |
良导体(导电传热) |
|
|
典型实例 |
NaCl、NaOH、Na2O、CaCO3 |
干冰、白磷、冰、硫磺 |
金刚石、SiO2、晶体硅、SiC |
Na、Mg、Al、Fe、Cu、Zn |
2. 化学键的极性与分子的极性
(1)化学键极性取决于成键原子是否相同,分子的极性取决于分子的空间构型
|
|
CH4 |
NH3 |
H2O |
CO2 |
C2H2 |
H2O2 |
|
化学键极性 |
|
|
|
|
|
|
|
分子极性 |
|
|
|
|
|
|
|
空间构型 |
|
|
|
|
|
|
(2)相似相溶原理:极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂。
1.
|
|
离子键 |
共价键 |
|
概念 |
使阴、阳离子结合成化合物的静电作用 |
原子之间通过共用电子所形成的相互作用 |
|
成键粒子 |
阴、阳离子 |
原子 |
|
成键性质 |
静电作用 |
共用电子对两原子的电性作用 |
|
成键条件 |
一般活泼金属(IA、IIA族)与活泼非金属(VIA、VIIA族)之间相互化合 |
通常同种非金属原子或不同种非金属原子之间 |
|
存在 |
离子化合物中一定存在离子键 |
①非金属单质的分子中(除稀有气体外)②非金属形成的化合物中③部分离子化合物中 |
|
影响因素 |
离子半径越小,所带电荷越多,离子键就越强 |
原子半径越小,共价键越强 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com