
3.两电极浸入电解质溶液且用导线连接或直接接触。
2.要有电解质溶液;
1.要有活动性不同的两个电极(一种金属与另一种金属或石墨或不溶性的金属氧化物);
4. 沉淀溶解平衡:
(1)沉淀溶解平衡:一定条件下沉淀的溶解速率与生成速率相等时,溶液呈饱和状态
(2)沉淀反应的应用:
沉淀的生成:如:Cu2+(Fe3+、Fe2+)离子和除去方法
沉淀的溶解:如:Mg(OH)2沉淀的溶解方法
沉淀的转化:如:水垢中CaSO4的除去,氟化物防治龋齿的化学原理等
21世纪教育网
3. 溶液PH的计算
(1)计算的原则酸溶液按C(H+),碱溶液按C(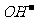 )计算
)计算
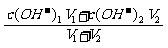
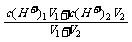
(2)强酸混合:c(H+)= 强碱混合:c(OH-)=
(3)强酸与强碱混合后,先判断溶液酸碱性再列式计算
(4)两强混合呈中性: 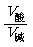 = 10
= 10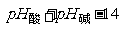
(5)若两溶液等体积混合且溶液的PH之和为14,则混合溶液呈弱的一方的性质
2. 中和滴定
(1)用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的实验方法
(2)原理:n(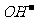 )=n(H+)
)=n(H+)
(3)关键:准确测定标准液与待测液的体积,准确判断滴定的终点
(4)仪器与操作:准备、滴定
(5)误差分析与数据处理
(6)溶液中PH的计算:
2. 盐的水解平衡:
(1)本质:弱电解质从逆向建立电离平衡时破坏了水的电离平衡
(2)影响因素:内因:有弱才水解,越弱越水解
外因:温度、浓度
(3)应用:
①判断盐溶液中离子种类和比较离子浓度
弱酸或弱碱,如CH3COOH、NH3•H2O和H2CO3
弱酸与其盐溶液如:HAC与NaAC,弱碱与其盐溶液NH4Cl与NH3•H2O
多元弱酸的酸式盐溶液如:NaHCO3、NaHC2O4溶液
②离子共存问题
Fe3+、Cu2+、NH4+、Al3+、Fe2+等离子只能存在于酸性溶液中
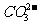 、
、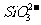 、
、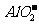 、
、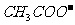 、
、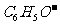 等离子只能存在于碱性溶液中
等离子只能存在于碱性溶液中
HCO3-在酸性与碱性溶液中均不能存大
泡沫灭火器中发生的反应
③某些盐或盐溶液制备、保存
FeCl3溶液的配制方法:
硅酸钠溶液在空气中久置变浑浊的原因,不能用玻璃瓶塞的原因
④Fe(OH)3胶体的制备明矾的净水作用
⑤弱电解质的证明
证明CH3COOH是弱酸的方法:
⑥解释某些化学现象及在生活生产中的应用
由MgCl2•6H2O制取无水氯化镁的方法:
AlCl3•6H2O和SOCl2混合加热可以得到得到无水氯化铝的原因
用TiCl4制取TiO2的反应等
1. 弱电解质的电离平衡电离平衡
(1)电解质与非电解质(注意CO2、SO2、NH3等水溶液可以导电但是非电解质)
(2)强弱电解质(注意KSCN等盐属于弱电解质,思考苯酚、水、乙醇、盐酸与钠反应的现象有什么不同)
(3)弱电解质的电离平衡(常见的H2CO3、NH3•H2O、CH3COOH等电离方程式的书写)
(4)水的电离,影响水的电离因素(酸,碱、盐、温度等)
(5)水的离子积常数(KW)
4. 了解难溶电解质的沉淀溶解平衡及沉淀转化的本质。
[教法指导]
本专题内容是近几年高考中的热点问题,也是学生普遍反映较难掌握的一部分内容,因此教师在突破本专题的瓶颈时,应采取适当的教学方法。首先应用化学平衡原理,来指导学生认识水溶液中离子平衡的实质,其次应将常见题型的解题方法进行总结归纳,最后应结合近几年的高考题逐步渗透今后的命题方向21世纪教育网
[知识网络]
3. 了解盐类水解的原理及影响盐类水解程度的主要因素,了解盐类水解的应用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com