
|
电解液 |
溶质类别 |
电解总反应式 |
相当于电解 |
溶液pH |
|
NaOH溶液 |
强碱 |
2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
水 |
升高 |
|
H2SO4溶液 |
含氧酸 |
降低 |
||
|
Na2SO4溶液 |
活泼金属的含氧酸盐 |
不 变 (两极混合液) |
||
|
CuCl2溶液 |
不活泼金属的无氧酸盐 |
CuCl2 Cu+Cl2↑ Cu+Cl2↑ |
电解质本身 |
接近7 |
|
HCl溶液 |
无氧酸 |
2HCl H2↑+Cl2↑ H2↑+Cl2↑ |
升高 |
|
|
NaCl溶液 |
活泼金属的无氧酸盐 |
2NaCl+2H2O H2+2NaOH+Cl2↑ H2+2NaOH+Cl2↑ |
电解质与水 |
升高 |
|
CuSO4溶液 |
不活泼金属的含氧酸盐 |
2CuSO4+2H2O 2Cu+O2↑+2H2SO4 2Cu+O2↑+2H2SO4 |
降低 |
|
|
NaCl(熔融) |
离子化合物 |
2NaCl 2Na+Cl2↑ 2Na+Cl2↑ |
电解质本身 |
|
|
Al2O3(熔融) |
2Al2O3 4Al+3O2↑ 4Al+3O2↑ |
原电池:负极:M-ne-=Mn+
正极:(1)酸性溶液中2H++2e-=H2↑
(2)不活泼金属盐溶液Mn++ne-=M
(3)中性、弱酸性条件下2H2O+O2+4e-=4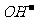
电解(镀)池:
阳极:(1)若阳极是由活性材料(除C、Pt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子而被氧化成阳离子;
(2)若阳极是由C、Pt、Au等惰性材料做成,阳极反应则是电解液中阴离子在阳极失去电子被氧化。阴离子失去电子能力大小顺序为: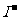 >
>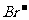 >
>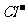 >
>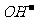 >含氧酸根>
>含氧酸根>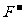 。
。
阴极:阴极反应一般是溶液中的阳离子得电子的还原反应,阳离子得电子能力大小顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。必须注意的是,电镀时通过控制条件,Fe2+和Zn2+得电子的能力强于H+
2.确定电解(镀)池电极名称的方法
方法一:与外电源正极连接的一极是阳极、与负极连接的一极是阴极。
方法二:电极上发生氧化反应的是阳极,发生还原反应的是阴极。
1.确定原电池电极名称的方法
方法一:根据电极材料的性质确定。通常是
(1)对于金属--金属电极,活泼金属是负极,不活泼金属是正极;
(2)对于金属--非金属电极,金属是负极,非金属是正极,如干电池等;
(3)对于金属--化合物电极,金属是负极,化合物是正极。
方法二:根据电极反应的本身确定
失电子的反应→氧化反应→负极;得电子的反应→还原反应→正极。
6.在同一电解质溶液中,金属腐蚀的快慢可用下列原则判断:电解原理引起的腐蚀>原电池引起的腐蚀>化学腐蚀>有防护措施的腐蚀
5.腐蚀的常见类型
(1)析氢腐蚀 在酸性条件下,正极发生2H++2e-=H2↑反应。
(2)吸氧腐蚀 在极弱酸或中性条件下,正极发生2H2O+O2+4e-=4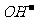 反应。
反应。
若负极金属不与电解质溶液发生直接的反应,则形成吸氧腐蚀的原电池反应。如生铁浸入食盐水中,会形成许多微小的原电池
4.电化学腐蚀实质:不纯金属或合金在电解质溶液中发生原电池反应。电化学腐蚀过程有电流产生。
3.化学腐蚀实质:金属和非电解质或其它物质相接触直接发生氧化还原反应而引起的腐蚀。其腐蚀过程没有电流产生
2.金属腐蚀分为化学腐蚀和电化学腐蚀
1.金属腐蚀的实质:金属原子失去电子被氧化而消耗的过程。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com