
18. (10分)373w.w.w.k.s.5.u.
c.o.m343近年来,我国酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(10分)373w.w.w.k.s.5.u.
c.o.m343近年来,我国酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
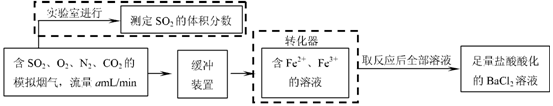 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。

A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(4)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+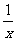 Sx 、
Sx 、
CO+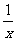 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+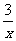 Sx 。其中COS中“C”化合价为
。
Sx 。其中COS中“C”化合价为
。
17.(9分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素,Y元素的单质在常温下为淡黄色固体。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐,该反应的离子方程式为________________ ____。
(2)X的硝酸盐水溶液显______性,用离子方程式解释原因____ _______
_____________。
(3)比较Y、Z气态氢化物的稳定性_____>_______(用分子式表示)
(4)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:_______________________。
16. 将4.6 g Na和2.7 g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
将4.6 g Na和2.7 g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
 A.反应中放出的气体在标准状况下的体积为2.24 L
A.反应中放出的气体在标准状况下的体积为2.24 L
 B.参加反应的水的质量与加入Al的质量相等
B.参加反应的水的质量与加入Al的质量相等
 C.所得溶液中Na+和Al3+的物质的量之比为2∶1
C.所得溶液中Na+和Al3+的物质的量之比为2∶1
 D.所得溶液中阳离子和阴离子的物质的量之比为1∶1
D.所得溶液中阳离子和阴离子的物质的量之比为1∶1

第II卷(非选择题 52分)
15. 某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是( )
某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是( )
 A.该条件下生成的水分子化学性质比较活泼
A.该条件下生成的水分子化学性质比较活泼

 B.该条件下H2被冷却为液态氢,液氢的水溶液具有
B.该条件下H2被冷却为液态氢,液氢的水溶液具有
 还原性
还原性
 C.该条件下H2燃烧生成了具有还原性的物质
C.该条件下H2燃烧生成了具有还原性的物质
 D.该条件下H2燃烧的产物中可能含有一定量的H2O2
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
14. 混合下列各组物质使之充分反应并加热蒸干,产物灼烧至质量不变,最终残留固体不是纯净物的是( )
混合下列各组物质使之充分反应并加热蒸干,产物灼烧至质量不变,最终残留固体不是纯净物的是( )
 A.在KI溶液中通入过量氯气
A.在KI溶液中通入过量氯气
 B.等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合
B.等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合
 C.物质的量之比为2:1的NaHCO3与Na2O2固体溶于水中
C.物质的量之比为2:1的NaHCO3与Na2O2固体溶于水中
 D.向Na2SiO3溶液中通入足量的CO2
D.向Na2SiO3溶液中通入足量的CO2
13. 下列说法或表示方法中正确的是( )
下列说法或表示方法中正确的是( )
A.  等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
 B.由C(金刚石)→C(石墨);ΔH=+119KJ/mol
可知,石墨比金刚石稳定
B.由C(金刚石)→C(石墨);ΔH=+119KJ/mol
可知,石墨比金刚石稳定
 C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=-285.8KJ/mol
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=-285.8KJ/mol
 D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
12、 下列各组溶液中所含溶质的物质的量相等,将其充分混合后不会产生沉淀的是( )
下列各组溶液中所含溶质的物质的量相等,将其充分混合后不会产生沉淀的是( )
 A.CaCl2、NaHCO3、KOH B.MgCl2、Ba(OH)2、HCl
A.CaCl2、NaHCO3、KOH B.MgCl2、Ba(OH)2、HCl
 C.FeCl3、H2S、HCl D.NaAlO2、K2CO3、NH3·H2O
C.FeCl3、H2S、HCl D.NaAlO2、K2CO3、NH3·H2O
11. 如图,B为常见金属或非金属单质,有下列转化关系:
如图,B为常见金属或非金属单质,有下列转化关系:

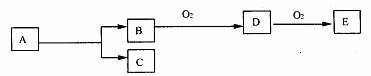





 若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
 A.AlCl3 B.H2O2 C.KCl D.NaCl
A.AlCl3 B.H2O2 C.KCl D.NaCl
10. 下列叙述中正确的是( )
下列叙述中正确的是( )
 A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B、凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C、两原子,如果核外电子排布相同,则一定属于同种元素
D、阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B、凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C、两原子,如果核外电子排布相同,则一定属于同种元素
D、阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
9.工业上制取CuSO4不是直接用铜与浓H2SO4反应,而是将Cu和少量的Ag的混合物浸在稀硫酸中并不断从容器下部吹入细小的空气泡,这样的优点是①不产生污染大气的SO2 ②提高H2SO4的利用率 ③节约能源; ④提高铜的利用率( )
 A.①②③
B.①④
C.①②③④ D.只有①②
A.①②③
B.①④
C.①②③④ D.只有①②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com