
4.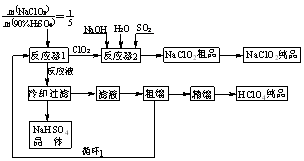 高氯酸(HClO4)常用于塑料、电镀、人造金刚石工业,亚氯酸钠(NaClO2)是一种新型的优良漂白剂。高氯酸联产亚氯酸钠的工艺流程如下:
高氯酸(HClO4)常用于塑料、电镀、人造金刚石工业,亚氯酸钠(NaClO2)是一种新型的优良漂白剂。高氯酸联产亚氯酸钠的工艺流程如下:
⑴反应器1中发生反应的化学方程式为____________________________________。
⑵通入反应器2的SO2作用是________;反应器2中发生反应的离子方程式为____________。
⑶循环1利用的物质是_______________。
通过物质的制备,考查方程式的书写。
答案 1.⑴Fe CO;⑵4NH3+5O2催化剂Δ4NO+6H2O;⑶3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;⑷NH4HC2O4
3.重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
高温煅烧还原法
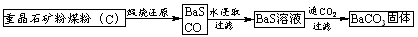
⑴煅烧还原的热化学方程式为:______________________________________。
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);ΔH=-1473.2 kJ·mol-1
C(s)+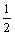 O2(g)=CO(g);ΔH=-110.5 kJ·mol-1 Ba(s)+S(s)=BaS(g);ΔH=-460 kJ·mol-1
O2(g)=CO(g);ΔH=-110.5 kJ·mol-1 Ba(s)+S(s)=BaS(g);ΔH=-460 kJ·mol-1
⑵经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)____________________________。
沉淀转化法 向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
⑶现有0.20 mol BaSO4,每次用1.00 L 2.0mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
⑷从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是_____________________。
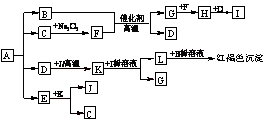
1.将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示,J是一种常见的金属单质,C是一种非极性分子。图中部分反应条件及生成物没有列出。
请按要求填空:
⑴单质J的化学式_____________,E的分子式是______________。
⑵写出B和F反应的化学方程式___________________。
⑶写出K和I的稀溶液反应的离子方程式___________________________。
⑷A的化学式为______________________________
本题根据产物的颜色及有关反应条件及C物质与Na2O2的反应来推导。考查N与Fe的性质。
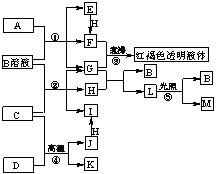 2,已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是位于元素周期表第六周期的一种金属元素的单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4 mol B和1 mol C,K只知含有CO 或CO2中的一种或两种。它们关系如图:
2,已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是位于元素周期表第六周期的一种金属元素的单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4 mol B和1 mol C,K只知含有CO 或CO2中的一种或两种。它们关系如图:
⑴写出下列物质的化学式:A__________ D_________。
 ⑵写出下列反应的化学方程式:
⑵写出下列反应的化学方程式:
②__________________________________________________。
⑤__________________________________________________。
⑶由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用________方法(填序号)
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可用铝热法,若反应中1 mol A参加反应,转移电子的物质的量为__________
⑷用C、J作电极,与硫酸构成如图所示电池,正极的电极反应为__________________________,当反应转移1mol电子时,负极质量增加_________ g。
9. (2009年海南卷)
(2009年海南卷) 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。




 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
 (3)写出另外一种实验室制取H的化学方程式
(3)写出另外一种实验室制取H的化学方程式
 (4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。


 [答案]
[答案]
 (1)
(1)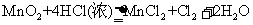 (2分)
(2分)
 (2)
(2)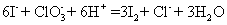 (2分)
(2分)
 (3)
(3)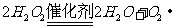 或
或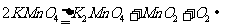 (其他合理答案也给分)(2分)
(其他合理答案也给分)(2分)
 (4)
(4)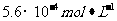 (3分)
(3分)
 [专题综合]
[专题综合]
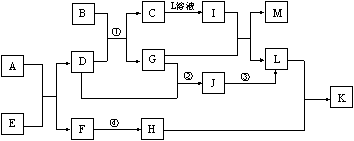
8.已知A-L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质。通常状况下,A、B均是淡黄色固体,D是气体单质,E是无色无味气体,K是不溶于水的酸。反应①-③是化学工业生产重要产品的全部反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如下图所示(反应时加入或生成的水均没标出)。
请填写下列空白:
(1)写出下列物质的化学式:B____;D的同素异形体___。(均填化学式)
(2)画出A中金属元素的原子结构示意图_______;指出E分子中共价键的类型(填“极性键”或“非极性键”)_____。
(3)指出反应①②③是吸热反应,还是放热反应?_____。
(4)完成下列反应方程式:
① I+G→M+L的离子方程式:___________。
② 写出反应④的化学方程式:_________。
[答案](1)FeS2;O3;(2)Na ;极性键;(3)放热反应;(4)①2Fe3+ + SO2
+ 2H2O
;极性键;(3)放热反应;(4)①2Fe3+ + SO2
+ 2H2O 2Fe2+ + SO42-
+ 4H+;②Na2CO3
+ SiO2
2Fe2+ + SO42-
+ 4H+;②Na2CO3
+ SiO2 Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
1、① 2MnO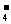 +5SO
+5SO +6H+==2Mn2++5SO
+6H+==2Mn2++5SO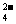 +3H2O;
+3H2O;
② Cl2+H2O+SO ==SO
==SO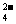 +2H++2Cl-
+2H++2Cl-
(3)在确定溶液中不含Ag+等干扰离子存在时可选用盐酸酸化的BaCl2溶液作试剂检验SO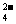 ,在确定溶液中不含SO
,在确定溶液中不含SO 等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO
等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO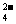 解析:考察离子的鉴定。
解析:考察离子的鉴定。
7.一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
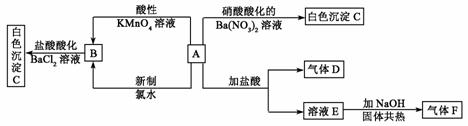
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)写出下列物质化学式:A:______;C:____;
(2)写出下列反应的离子方程式:
① A和酸性KMnO4溶液:____________。
② A和新制氯水:________。
(3)通过本题的解答在检验SO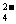 时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:__________。
时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:__________。
[答案](1)(NH4)2SO3;BaSO4;
6. A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置______。
(2)写出C、G物质的化学式。C_____ G____
(3)写出①、④、⑥反应的化学方程式:
反应①:________反应④:__________反应⑥:__________
(4)从能量变化的角度看,①②③反应中属于△H<0的反应是____(填序号)
[答案](1)第四周期、第Ⅷ族;(2)FeCl2 Al2O3;(3)8Al+3Fe3O4 4Al2O3+9Fe;2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)①②
4Al2O3+9Fe;2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)①②
[解析]考察电解知识和金属知识的整合。
5.下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色。

(1)基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
(2)写出K和E反应的离子方程式_____。写出F溶液和H反应的离子方程式_______。
(3)已知:由G分解得到的H、I、J三者的物质的量之比为1∶1∶1,则G的化学式为____。
[答案](1)氯碱工业;2NaCl+2H2O H2↑+C12↑+2NaOH;(2)2Fe2++Cl2=2Fe3++2Cl-;FeO+2H+=Fe2++H2O(3)FeC2O4
H2↑+C12↑+2NaOH;(2)2Fe2++Cl2=2Fe3++2Cl-;FeO+2H+=Fe2++H2O(3)FeC2O4
[解析]考察无机推断和定量计算相结合。
4.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。试填空:
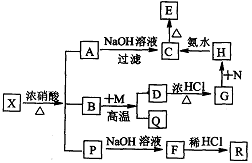
(1)X的化学式为 。(2)N应选择下列物质中的_____(填序号)
a. KMnO4 b. HNO3 c. H2O2 d. C12
(3)写出反应的离子方程式:
D→G ;
H→C 。
(4)B+M反应的化学方程式: 。
答案:(1)Fe3C;(2)c d;(3)Fe3O4十8H+==Fe2++2Fe3++4H2O;
Fe3++3NH3·H2O==Fe(OH)3↓++3NH4+

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com