
2.(浙江省宁波市鄞州高级中学08-09学年高三上学期期中考试)已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于氨气吸收的是
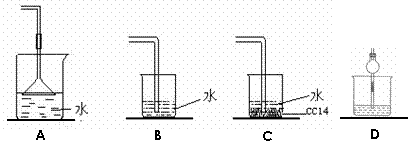
[解析]A项倒扣的漏斗使NH3充分吸收同时防止倒吸现象的发生;B项由于NH3易溶于水,可发生倒吸现象;C项由于NH3难溶于CCl4,NH3与CCl4接触不易发生倒吸现象;D项由于干燥管的上部大,防止倒吸现象的发生。故B项正确。
[答案]B
1.(海南三亚一中2009届高三年级第三次月考)下列操作中不是从安全角度考虑的是
A.做氢气还原氧化铜的实验时先通氢气以排净装置中的空气再加热
B.稀释浓硫酸时,将浓硫酸沿烧坏壁慢慢注入水中并不断搅拌
C.给试管中的液体加热时,试管口不能对着自己或他人
D.用废铁屑制硫酸亚铁时,先将废铁屑放在碱液中加热1-2min
[解析]A氢气还原氧化铜实验先再氢气通加热,则氢气不会与空气混合受热而易引起爆炸;B稀释浓硫酸时,将浓硫酸沿烧坏壁慢慢注入水中并不断搅拌,这样能使混合产生的大量热及时散发,不会引起液体飞溅;C给试管中的液体加热时,试管口不能对着自己或他人,这样防止伤人;D用废铁屑制硫酸亚铁时,先将废铁屑放在碱液中加热1-2min以除去废铁表面的油污,此操作不是从安全角度考虑的21世纪教育网
[答案]D
16.(2009广东卷19)某试验小组利用如下装置(部分固定装置略)制备氧化钙(Ca3N2),并探究其实验式。
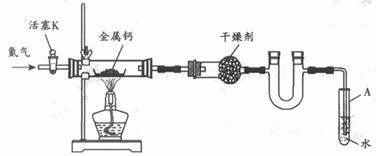
(1)按图连接好实验装置。检查装置的气密性,方法是 。
(2)反应过程中末端导管必须插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
|
空瓷舟质量m0/g |
瓷舟与钙的质量m1/g |
瓷舟与产物的质量m2/g |
|
14.80 |
15.08 |
15.15 |
①计算得到实验式CaxN2,其中x= .
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据: 。
[解析](1)检查装置气密性首先要关闭活塞K,并将末端导管插入试管A的水中形成密闭系统,而是要通过升温形成压强差。(2)由题给(4)的②可知,若N2中混有O2会使产物不纯,因此要隔绝氧气对反应的影响,末端导管必须插入试管A的水中可防止氧气进入。(3)此处要联想初中氧气制备作答,因为温度降低会导致压强减小,出现倒吸现象,所以要首先撤出导管,在熄灭酒精灯。(4)①由题给实验数据可知:
m(Ca )=m1-m0=15.08-14.80=0.28g
则n(Ca )=0.28g/40g·moL-1=0.007mol
m(CaxN2)=15.15-14.80=0.35g
则m(N)=0.35g-0.28g=0.07g
n(N)=0.07g/14g·mol-1=0.005mol 因为n(Ca ):n(N)=7:5,所以x=2×7/5=2.8
②因为钙的总量不变,若通入的N2中混有少量O2,所得产物中会混有氧化钙,因为氮的相对原子质量小于样的相对原子质量,结果m2偏大,n(N)会偏大,所以x值会减小。
[答案](1)关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质试管,若末端导管有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,在导管内形成一段水柱,并且一段时间不回落,则证明装置的气密性良好21世纪教育网 (2)反应过程中末端导管必须始终插入试管A的水中,目的是:防止空气中的氧气通过末端导管进入实验装置,氧化单质钙,生成氧化钙,引入杂质。 (3)反应结束后,先将末端导管从试管A中拔出,再熄灭酒精灯。 (4)x=2.8;因为钙的总量不变,若通入的N2中混有少量O2,所得产物中会混有氧化钙,因为氮的相对原子质量小于样的相对原子质量,结果m2偏大,n(N)会偏大,所以x值会减小。
[考点分析]这是一条以定量试验为基础的综合性较强的实验题,主要涉及:气密性检查、实验安全、实验计算、误差分析、装置分析和评价21世纪教育网
[专题突破]
15.(2009江苏高考化学15)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量 Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量 Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中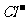 含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3
溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。①上述测定过程中需用溶液润洗的仪器有:
。②计算上述样品中CaCl2·2H2O的质量分数为:
。③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有:
;
。
含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3
溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。①上述测定过程中需用溶液润洗的仪器有:
。②计算上述样品中CaCl2·2H2O的质量分数为:
。③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有:
;
。
[解析](1)Fe(OH)3若没有沉淀完全,则会有Fe3+存在,检验Fe3+的存在用KSCN溶液最好,检验时一定要取上层清液,检验现象才能明显;
(2)空气中的CO2会影响产品的纯度,所以应该防止溶液吸收空气中的CO2。
(3)①滴定实验中,需润洗的仪器有滴定管、移液管,该实验是用 AgNO3 溶液滴定 待测液的,所以需要润洗的仪器一定有酸式滴定管。
② 根据关系式:CaCl2·2H2O ~ 2AgNO3
147 2
α×0.7500×25/250 0.05000×0.02039
解得:α=0.9991=99.9%
③根据反应:CaCl2·2H2O ~ 2Cl-~ 2AgNO3若Cl-偏多,则滴定的结果就会偏高,所以样品中若混有含氯量高于CaCl2的或CaCl2·2H2O 晶体中的结晶水失去一部分都能使CaCl2·2H2O的质量分数偏高;
[答案](1)取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3 沉淀完全(2)防止溶液吸收空气中的CO2 (3)①酸式滴定管 ②99.9% ③样品中存在少量的NaCl ,少量CaCl2·2H2O 失水
[考点分析]本题以工业生产为载体,综合考查化学实验。考查物质的检验、常见仪器的使用注意点、误差分析、计算等方面,综合考查学生对实验原理的理解能力,对实验方案的评价分析能力21世纪教育网
14. 现有下列仪器或用品:①铁架台(含铁圈,各种铁夹);②锥形瓶;③酸式滴定管与碱式滴定管;④烧杯(若干);⑤玻璃棒;⑥胶头滴管;⑦天平(含砝码);⑧滤纸;⑨量筒;⑩过滤漏斗。
(1)过滤时,应选用的上述仪器是 (填编号)。
(2)配制一定物质的量浓度的溶液时,还缺少的仪器是 。
(3)在中和滴定使用滴定管前,首先应 。
[解析]这类试题的解题方法是首先看题目选项的具体操作。联想该操作的仪器、方法、注意事项等,对比题目中所给的仪器进行组合,看仪器是否完全具备进行某一项实验,这样才能得出正确结论,有时试题是给出一些仪器来完成某些实验操作,而所给的仪器不全,其解题方法与之类似,即通过联想完成。
[答案](1)过滤所用的仪器有:铁架台、烧杯、玻璃棒、滤纸、过滤漏斗。
(2)配制一定物质的量浓度的仪器有:天平(含砝码)、容量瓶、烧杯、玻璃棒、胶头滴管21世纪教育网
(3)检查活塞是否漏水,在确保不漏水后方可使用。
[考点分析]通过列举常见的仪器,将常见的三个实验联系起来,考查学生对化学基本实验的熟练程度21世纪教育网
13.(山东诸城一中2009届高三年级阶段性评估)下列各图所示装置的气密性检查中,漏气的是
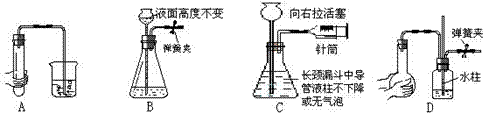
[解析]C项中向外拉活塞,使锥形瓶内的压强减小,由于外界大气压的作用,长颈漏斗的导管下端的液柱应下降或锥形瓶中液体中产生气泡。故C装置气密性漏气。
[答案]C
[考点分析]本题主要考查常见装置的气密性检查。
12.(安徽怀远二中2009届高三上学期第四次月考)下列实验操作或所记录的数据合理的是
A.NaOH溶液可保存在玻璃塞的试剂瓶中
B.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中
C.一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3
D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉
[解析]NaOH溶液等碱性物质不能保存在玻璃塞的试剂瓶中,应用橡胶塞或软木塞;pH试纸测得的值范围是1-14的整数;由于亚铁离子水解和易被氧化,配制硫酸亚铁溶液时,应将绿矾晶体溶于一定浓度的硫酸中,再加入一定量的铁粉。
[答案]B
[考点分析]本题主要考查试剂的保存、数据的记录、溶液的配制等三个方面。
11.(宁夏银川市实验中学2009届高三年级第三次月考)某学生做完实验后,采用下列方法清洗所用仪器:
①用浓氨水清洗做过银镜反应后的试管 ②用酒精清洗做过碘升华的烧杯 ③用浓盐酸清洗做过高锰酸钾分解实验的试管 ④用盐酸清洗长期存放三氯化铁溶液的试剂瓶 ⑤用氢氧化钠溶液清洗盛过苯酚的试管 ⑥用热氢氧化钠的浓溶液清洗沾有硫磺的试管
下列对以上操作的判断。正确的是
A.除①外都对 B.除⑥外都对 C.④⑤不对 D.全都正确
[解析]做过银镜反应后的试管应用稀硝酸清洗。
[答案]A
[考点分析]本题主要考查常见实验或试剂保存后的仪器洗涤。
10.(安徽泗县一中2008-2009学年第一学期高三第二次考试)下列化学实验基本操作中,正确的是
A.配制溶液时,将量筒中液体倒入烧杯后,应将量筒洗涤,将洗涤液也倒入烧杯
B.稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并不断搅拌
C.用干燥的pH试纸分别测1 mol·L-1的NaOH溶液和1 mol·L-1的H2SO4的pH值
D.向酒精灯加酒精时,应将试剂瓶中的酒精直接倒入酒精灯中
[解析]量筒只是粗略量取液体体积的仪器,不能洗涤;pH试纸测得的值范围是1-14的整数,而通过计算1 mol·L-1的H2SO4的pH值应小于0;向酒精灯加酒精时,应用普通漏斗向酒精灯中加酒精。
[答案]B
[考点分析]本题考查:溶液的配制、浓溶液的稀释、pH试纸的使用、酒精灯添加酒精的注意点等四个方面21世纪教育网
9. (2008年上海卷18)设计学生试验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是21世纪教育网
(2008年上海卷18)设计学生试验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是21世纪教育网
A.用二氧化锰(粉末)与双氧水制氧气
B.用锌粒与稀硫酸制氢气
C.用硫化亚铁(块状)与盐酸制硫化氢
D.用碳酸钙(块状)与稀硫酸制二氧化碳
[解析]利用启普发生器的原理,进行创新应用。本题考查启普发生器的应用的注意事项,从而考查了实验基本操作。选项A中二氧化锰为粉末状物质,关闭K时,反应不能停止;选项B中Zn为颗粒状物质,关闭K可以使试管内的气体压强增大,能达到反应停止;选项C中与选项B相似,但H2S有毒,对空气造成污染;选项D中CaCO3与H2SO4反应生成CaSO4,由于CaSO4微溶于水,附在CaCO3表面,使反应停止,达不到制取CO2的目的。
[答案]B
[考点分析]本题主要考查实验装置的选择原理,通过对装置的分析,选择合适的试剂进行制备21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com