
3.(2009届第一学期徐汇区高三1月学习能力诊断卷)用NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,1L液态水中含有的H+ 数目10-7NA
B.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA
C.常温下,pH=3的醋酸溶液中,醋酸分子的数目一定大于0.001NA
D.1mol碳烯(:CH2)中含有电子数为8NA
[解析]A错,标准状况下水的离子积常熟小于1×10-14;B错,由于不知道气体的的温度和压强,无法计算气体的物质的量,也无法计算专一电子数;C错,不知道溶液的体积和醋酸浓度,无法计算醋酸分子数。D正确,:CH2粒子中含有8个电子21世纪教育网
[答案]D
2.(2008山东烟台期中)将标准状况下a L HCl溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是 ( )
A.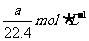 B.
B.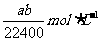
C. D.
D.
[解析]紧扣物质的量浓度的定义式进行运算,同时注意单位的换算。HCl的物质的量为a/22.4mol,溶液的体积为[(a/22.4)×36.5+1000]/(b÷1000)L。
[答案]D
1.(山东省文登市天福山中学2009届高三第四次月考)下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不记)。其中能表示等质量的氢气与氦气的是( )
A. B.
B.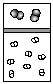 C.
C. D.
D.
[解析]根据阿伏伽德罗定律的推论,同温同压下,分子数之比等于气体体积比,只有A正确。
[答案]A
16.(2008天津卷)(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
[解析](1)标出化合价升降:C2O42- CO2,MnO4-
CO2,MnO4- Mn2+;根据化合价变化,求2和5的最小公倍数:
Mn2+;根据化合价变化,求2和5的最小公倍数: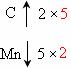 ,可知在C2O42-前加系数5,在MnO4-前加系数2,然后根据电荷守恒和原子守恒,利用观察法,可得配平方程式:5C2O42-+2MnO4-+16H+=1OCO2↑+2Mn2++8H2O。
,可知在C2O42-前加系数5,在MnO4-前加系数2,然后根据电荷守恒和原子守恒,利用观察法,可得配平方程式:5C2O42-+2MnO4-+16H+=1OCO2↑+2Mn2++8H2O。
(2)①加NaOH变为浅红色,说明溶液呈弱碱性,则溶液中被中和的n(H+)=n(OH-)=0.25mol·L-1×0.02L=0.005mol。
②加入酸性KMnO4将C2O42-氧化,恰好反应时,溶液由无色变成紫红色;根据方程式可得关系式:5C2O42- 2MnO4-,n(C2O42-)=×n(KMnO4)=×0.1mol·L-1×0.016L=0.004mol。
2MnO4-,n(C2O42-)=×n(KMnO4)=×0.1mol·L-1×0.016L=0.004mol。
③因为和NaOH反应时,H+来源于H2C2O4·2H2O和KHC2O4,而和KMnO4反应时,C2O42-也来源于二者。设试样中含H2C2O4·2H2O、KHC2O4的物质的量分别为x、y,根据题意得:
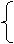 x+y=0.04
x+y=0.04
2x+y=0. 05
解之得:x=0.01mol,y=0.03mol。故m(H2C2O4·2H2O)=126g·mol-1×0.01mol=1.26g,则试样中H2C2O4·2H2O
的质量分数=×100%=21%;m(KHC2O4)=
128g·mol-1×0.03mol=3.84g,故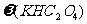 =×100%=64%。
=×100%=64%。
[答案](1)5 2 16 10 2 8 (2)①0.005 ②无色 紫红色 0.004 ③21% 64%。
[考点分析]以氧化还原反应为载体,考查物质的量应用到化学方程式的计算。
[专题突破]
15.(09江南十校高三第五次月考)取一定量的Na2CO3、NaHCO3和 的混合物与250ml,100mo1·L-1过量盐酸反应,生成2016LCO2(标准状况),然后加入500ml,0100mo1L-1Ba(OH)2溶液,得到沉淀的质量为233g,溶液中过量的碱用100ml,100mo1·L-1盐酸恰好完全中和。计算混合物中各物质的质量21世纪教育网
的混合物与250ml,100mo1·L-1过量盐酸反应,生成2016LCO2(标准状况),然后加入500ml,0100mo1L-1Ba(OH)2溶液,得到沉淀的质量为233g,溶液中过量的碱用100ml,100mo1·L-1盐酸恰好完全中和。计算混合物中各物质的质量21世纪教育网
[解析及答案]混合物中Na2SO4的质量=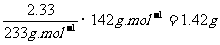
设混合物中NaCO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量
=
与Na2CO3、NaHCO3反应的盐酸的物质的量为
0250L×100mo1L-1-0500L0100 mo1L-1×2+0010L×100 mo1L-1=0160mol
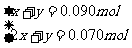
解得:X=0070mol Y=0020mol
Na2CO3质量=0070mol×106g mo1L-1=742g NaHCO3质量=0020mol×84g mo1L-1=168g
考点分析:本题通过物质之间的相互转化,考查将物质的量应用于化学反应方程式的计算。
14.下列说法或计算正确的是 ( )
A. 采用加热蒸发溶剂的方法可以使浓度为2mol/L的氢溴酸溶液的浓度变为4mol/L
B. m g H2和n g He,在同温同压下密度之比等于m:n
C. 只有标准状况下,等物质的量的乙烯和一氧化碳所含的分子数才相等
D. 将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发,且蒸发过程中无溶质析出),所得溶液体积为V L,溶质的质量分数为蒸发前的2倍.设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为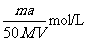
[解析]A错,因为HBr比水容易挥发,所以加热蒸发,浓度更低;
B错,因为ρ=M/Vm,所以同温同压下ρ(H2)/ρ(He)=Μ(H2)/Μ(He)=2/4=1/2;
C错,根据n=N/NA,物质的量相等,无论在什么条件下分子数都相等;
D正确,蒸发掉m g水溶质的质量分数为蒸发前的2倍,则原来溶液质量为2mg,
n=2m×a%/M mol=am/50M mol,C=n/V=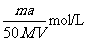
[答案]D
[考点分析]本题考查溶液浓缩、阿伏伽德罗定律的推论等知识点。
13.(2008南通一模)阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.4 g重水(D2O)中所含质子数为0.2×6.02×1023
B.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2×6.02×1023
C.4.48 L H2和O2的混合气体中所含分子数为0.2×6.02×1023
D.0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2×6.02×1023
[解析]4 g(0.2 mol)重水含2×6.02×1023个质子;4.48 L H2和O2的混合物若在标准状况下所含分子数就是0.2×6.02×1023;Cl2与H2O的反应是可逆的,0.2 mol Cl2与水反应则转移电子数小于0.2×6.02×102321世纪教育网
[答案]B
[考点分析]本题以阿伏伽德罗常数的考查为载体,考查学生对化学基本概念的掌握应用程度和相关计算能力。
12.(甘肃省兰州一中2008-2009高三上学期第三次月考)溶液的配制过程 能引起浓度偏高的是
①用1g 98%的浓硫酸加4g水配19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线。
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水。
A.①③⑤ B.②④⑤ C.③④ D.④⑤
[解析]①1×98%/(1+4)=19.6%;②没有误差;③10%的硫酸和90%的硫酸的密度分别为ρ1、ρ2,ρ1<ρ2,(Vρ1×10%+ Vρ2×90%)/( Vρ1+ Vρ2)=
10%+ Vρ2×80%/( Vρ1+ Vρ2)=10%+ 2Vρ2×40%/( Vρ1+ Vρ2)>10%+40%=50%;
④混合后溶液的体积小于100ml,浓度偏高;⑤解法同③,偏低。
[答案]C
[考点分析]本题主要考查一定物质的量浓度的溶液配制的误差分析。
11.(2008海南卷)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A. 甲的分子数比乙的分子数多
B. 甲的物质的量比乙的物质的量少
C. 甲的摩尔体积比乙的摩尔体积小
D. 甲的相对分子质量比乙的相对分子质量小
[解析]温度和压强相同时,气体摩尔体积相同,又等质量且甲的密度大于乙的密度,所以甲中气体的体积小于乙中气体体积,因此甲中气体的分子数比乙的分子数少,.甲的物质的量比乙的物质的量小,甲的相对分子质量比乙的相对分子质量大。
[答案]B
[考点分析]本题考查阿伏伽德罗定律的推论。
10.(2008山东卷)NA 代表阿伏加德罗常数,下列叙述错误的是 ( )
A. 10 mL 质量分数为 98 %的 H2SO4,用水稀释至 100 mL H2SO4 的质量分数为 9.8 %
B. 在 H2O2 + Cl2 = 2HCl + O2 反应中,每生成 32g氧气,则转移 2 NA 个电子
C.标准状况下,分子数为NA的 CO 、C2H4 混合气体体积约为 22.4L ,质量为 28g
D.一定温度下, 1 L 0.5 mol/L NH4Cl 溶液与 2 L 0. 25mol/L NH4Cl 溶液含 物质的量不同
物质的量不同
[解析]A中根据C=1000dω/W,其中d是溶液密度,ω是溶液质量分数,稀释至100ml,物质的量浓度变为原来的1/10,又硫酸溶液的浓度越大,密度越大,所以H2SO4 的质量分数大于 9.8 %;B中根据反应可知H2O2全部作还原剂,所以每生成 32g氧气即1mol,则转移 2 NA 个电子;C中注意CO 、C2H4的式量相等;D中两份溶液中铵根离子的浓度不同,水解程度不同,所以NH4+ 物质的量不同21世纪教育网
[答案]A
[考点分析]本题以阿伏伽德罗常数的考查为载体,具体考查溶液的稀释、电子的转移、分子数与质量的关系、溶液中因水解程度不同离子浓度的不同等知识点。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com