
[典例精析]
1.(2009广东卷11).元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
[解析]由题目信息可推断出,X为Na ,Y为Cl,Z为O。同周期(第三周期中)X(Na)的金属性最强,A正确;同周期元素从左向右原子半径减小,原子半径X(Na)>Y(Cl),电子层结构相同的离子,离子半径随核电荷数的增加而减小,离子半径X(Na+)<Z(O2-),B错误;同族元素中(VIA族)Z(O)的氢化物稳定性最高,C正确;同周期(第三周期中)Y(Cl)的非金属性最强,则最高价含氧酸的酸性最强(HClO4),D正确。
[答案]B
[考点分析]本题考查元素周期律的相关知识如:金属性强弱、半径大小比较、氢化物的稳定性、最高价含氧酸的酸性。

①键的极性与分子的极性。错因是混淆键的极性和分子极性的研究对象。
②晶体类型与所含元素、物质类型。晶体类型由晶体构成粒子和结合力决定,与元素种类,物质类型没有必然联系。经常互推没有因果关系的概念。
③晶体类型与分摊法:确定晶体类型时,对于原子晶体(如金刚石、二氧化硅晶体)、氯化钠、氯化铯晶体可以用分摊法。而对于分子晶体,不必用分摊法。例如,计算白磷(P)分子中化学键数,可直接根据正四面体结构计算,经常犯思维定势错误,确定分了晶体组成也用分摊法。
④晶体构成粒子内化学键与粒子间作用力。对于原子晶体、离子晶体、金属晶体,化学键与粒子间作用力类型一致;但是,对于分子晶体,一般分子内存在共价键,分子间存在分子间作用力或氢键。例如,冰由水分子靠氢键构成,而水分子内存在氢氧极性共价键。分子晶体熔融时只破坏分子间作用力,而不影响分子内化学键。稀有气体分子是单原子分子,分子内没有化学键,形成的晶体是分子晶体而不是原子晶体。经常认为粒子之间作用力都是化学键。
⑤离子晶体与分子。一般认为离子晶体不含分子,其实有一部分离子晶体中含有不能自由移动的分子。例如,蓝矾中水分子,[Ag(NH3)2]OH、[Pt(NH3)2]Cl2中含有氨分子,经常忽视特殊与一般关系。
⑥化学键与化合物类型。离子化合物一定含离子键,可能含共价键,如NaOH、Na2O2、CaC2、NH4Cl等;共价化合物一定含共价键,不含离子键。例如,H2O2,C2H2,CH3CH2CH3等,易误认为一种晶体只含一种化学键。
5.(安徽省六安市08-09年度高三年级第一次调研考)(8分)Ba2+是一种重金属离子,对生物体爱,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL0.100mol·L-1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要 21世纪教育网
(2)需准确称取Na2S2O3固体的质量为 g。
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为CrO2-7;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;②I2+2S2O32- 2I-+S4O62-.试计算该工厂废水中Ba2+的物质的量浓度21世纪教育网
[答案](1)烧杯、胶头滴管 (2)3.95
(3)根据题意有:
Ba2+ - BaCrO4 - 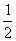 Cr2O72- -
Cr2O72- - 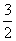 I2 - 3S2O32-
I2 - 3S2O32-
1 mol 3mol
c(Ba2+)×50.00mL×10-3L·mL-1 0.1mol·L-1×36.00mL×10-3L·mL-1
c(Ba2+)=0.24mol·L-1(4分)
21世纪教育网
4.(山东省泰安英雄山中学2009届高三年级第一次复习检测化学卷)
(1)下面是用98%的浓度H2SO4(ρ=1.84/cm3)配制成0.5mol·L-1的稀H2SO4500mL的操作,请按要求填空:
①所需浓H2SO4的体积为
②如果实验室有15mL、20mL、50 mL量筒,应选用 mL量筒最好。
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的烧杯里,并不断搅拦,目的是
④将 的上述溶液沿 注入______中,并用50 mL蒸馏水洗涤烧杯2-3次,洗涤液要一并注入上述容器中,并摇匀。
⑤加水至距刻度1-2㎝时,改用 加水,使溶液的凹液面正好跟刻度相平。
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响?(填偏高、偏低或不变)
①定容时观察液面俯视 ;
②NaOH颗粒表面部分变质 ;
③用胶头滴管向容量瓶中加水时凹面高于刻度线,此时立即用胶头滴管将瓶内液体吸出,使凹液面与刻度线相切
[答案](1)①13.6mL ②15 ③混合均匀,使热量迅速扩散
④冷却至室温 玻璃棒 500mL容量瓶 ⑤胶头滴管
(2)①偏高 ②偏低 ③偏低
3.设NA表示阿伏加德罗常数,下列说法正确的是
①6.8g熔融的KHSO4中含有0.1Na个阳离子。
②1L1mol/L的盐酸溶液中,含HCl分子数为1Na。
③常温常压下,11.2L的CH4中含有的H数为2Na。
④0.1molNa2O2与水完全反应,转移0.2NA的电子。
⑤62gNa2O溶于水中,所得溶液中有1Na个O2-
⑥1L1mol/L的醋酸溶液中离子总数为2Na
⑦标准状况下,22.4L氩气含有原子数为2Na。
⑧常温常压下,32gO2、O3的混合物含有2Na个氧原子。
⑨1L1mol/L的酒精溶液,含有1Na个分子。
⑩1molFe和足量的盐酸反应,失去3Na个电子。
A.①②⑤⑦⑧ B.②④⑥⑧⑩ C .⑧⑩ D .⑧
[解析]①错,在熔融条件下,它的电离方式是可KHSO4=K+ + HSO4- ,阳离子只有K+ ,为0.05NA个。
②错,HCl在溶液中全部电离,没有HCl分子存在。
③错,常温常压下,11.2L的CH4中,CH4物质的量不等于0.5mol,
④错,过氧化钠和水反应是歧化反应,一半的得电子,一半失电子,转移0.1NA的电子
⑤错,O2-在溶液中不存在,
⑥错,醋酸是弱电解质,不可能完全电离,离子总数小于2Na
⑦错,氩是单原子分子,1mol氩气含有原子数为1Na
⑧正确,32gO2、O3的混合物,可以理解是32g氧原子,n(O)=32g/16g/mol=2mol
N(O)=2NA ,质量和物质的量关系,与温度压强没有关系。常温常压下容易产生误导
⑨错,1L1mol/L的酒精溶液,应该包括水分子和酒精分子,
⑩错,Fe和盐酸反应生成Fe2+,1molFe和足量的盐酸反应,失去2Na个电子
[答案]D
2.(常州一中2009届12月高三化学月考)质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为
A.大于2c mol/L B.等于2c mol/L
C.小于2c mol/L D.在c mol/L-2c mol/L之间
[解析]KOH溶液的浓度越大密度越大;C=1000ρ1a%/40 , 蒸发后的溶液中
C(浓)= 1000ρ2·2a%/40 ,则C(浓)=2Cρ2/ρ1 ,因为ρ2>ρ1 ,则C(浓)>2C
[答案]A
1. (江苏省启东中学2009届高三第一学期第二次月考)NA代表阿伏加德罗常数。下列说法中,不正确的是
A.标准状况下,NO和 O2各11.2 L 混合,所得混合气体的分子总数为 0.75 NA
B.25℃时,l L pH=13的Ba(OH)2 溶液中含有OH―的数目为0.1 NA
C.1 mol C30H62 分子中含有共价键的数目为 91 NA
D.2.8g 乙烯与丙烯的混合物中含碳原子的数目为 0.2NA
[解析]A错,因为发生反应为2NO+O2=2NO2 , 2NO2 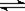 N2O4,所得混合气体的分子总数小于 0.75 NA ;B正确,pH=13,则C(OH-)=0.1mol.L-1,
l L溶液中含有OH―的数目为0.1 NA;C正确,因为每个C形成4个价键,每个H形成1个价键,每个价键被两个原子共用,所以C30H62
分子中含有共价键的数目(30×4+62)/2=182,则1moL C30H62
分子中含有共价键的数目为 91 NA;乙烯与丙烯的最简式都是CH2,2.8g乙烯与丙烯的混合物中相当于含有0.2molCH2。
N2O4,所得混合气体的分子总数小于 0.75 NA ;B正确,pH=13,则C(OH-)=0.1mol.L-1,
l L溶液中含有OH―的数目为0.1 NA;C正确,因为每个C形成4个价键,每个H形成1个价键,每个价键被两个原子共用,所以C30H62
分子中含有共价键的数目(30×4+62)/2=182,则1moL C30H62
分子中含有共价键的数目为 91 NA;乙烯与丙烯的最简式都是CH2,2.8g乙烯与丙烯的混合物中相当于含有0.2molCH2。
[答案]A
6.某研究性学习小组用化学法测量一个不规则容器的体积。方法是:把35.1gNaCl加入500mL的烧杯中,用150mL水使之完全溶解;将溶解后的溶液全部转移入不规则容器,用蒸馏水稀释至充满容器;从中取出100mL溶液,恰好使20mL0.100mol/L的AgNO3溶液完全反应。则容器的体积是 mL ;最后溶液中NaCl的物质的量浓度是
moL/L。根据以上信息能求出原浓溶液的质量分数和物质的量浓度吗?若能求出,写出解题过程,若不能说明还需要什么数据?
[解析]AgNO3+NaCl=AgCl↓+NaNO3 ,所以100mL溶液中
n(NaCl)=n(AgNO3)=0.100mol×0.02L=0.002mol;m(NaCl)=0.002mol×58.5g/mol=0.117g;
V(容器)=100mL×35.1g/0.117g=30000mL=30L ;最后稀溶液中C(NaCl)=0.002moL/0.1L=0.02mol/L
原溶液的质量分数可以求,过程是:W(NaCl)=[35.1g/(150mL×1g·mL-1+351.g)
×100%=18.96%;由于不知道溶液的密度,不能知道溶液的体积,无法求溶液的物质的量浓度
[答案]30mL ;0.02mL;能求质量分数,不能求物质的量浓度,需要密度,求质量分数的过程是:W(NaCl)=[35.1g/(150mL×1g·mL-1+351.g)×100%=18.96%
[专题综合]
5.(2008扬州二调)质量分数为ω的NaOH溶液,其物质的量浓度为a mol·L-1,加热蒸发水份使其质量分数变为2ω,此时,该溶液中NaOH的物质的量浓度为b mol·L-1,则a与b的关系正确的是
A.b=2a B.a=2b C.b<2a D.b>2a
[解析]根据C=1000dω/W,其中d是溶液密度,ω是溶液质量分数,所以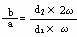 ,由于NaOH溶液密度大于水,所以浓度越大的密度越大,所以d2大于d1,所以b>2a
,由于NaOH溶液密度大于水,所以浓度越大的密度越大,所以d2大于d1,所以b>2a
[答案]D
4.(江苏省口岸中学09届秋学期高三年级第二次月考)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A.甲的相对分子质量比乙的相对分子质量小
B. 甲的摩尔体积比乙的摩尔体积小
C.甲的分子数比乙的分子数少
D.甲中所含的原子数比乙中的所含的原子数少
[解析]两容器的温度和压强均相同,气体质量相同,且甲的密度大于乙的密度,根据V=m/ρ,V(甲)< V(乙),则n(甲)< n(乙);气体摩尔体积只与条件有关,与气体的多少和类型无关,B错;由于不知道分子组成,无法比较原子数,D错;无法计算相对分子质量,A错。
[答案]C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com