
1. 方法与技巧
(1) 一般采用“概念对比法”或“反例否定法”等。化学基本概念的有关知识比较零碎,容易混淆,我们在记忆时一定要记牢,特别是一些概念、定义中的关键字更是要记忆准确,这是解决这类题的关键。
(2) 此类题有不少是选择题,可采用筛选法、排除法、估算法等各种方法使解题的速度和准确性大大提高21世纪教育网
8. 学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:(1)在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________(2)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(3)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用________试纸检验。上述异常现象产生的原因是__________________。
VI 实验结论:_____________________________________________________________
[答案]
I探究氧化铁、氧化铜、氧化铬对氯酸钾受热分解反应的催化作用,或二氧化锰、氧化铁、氧化铜、氧化铬催化能力的比较。其他合理也给分 (1分)
II大试管、酒精灯、计时器(或秒表)(3分);
(1)普通漏斗;烧杯(2分) (2)40.8 (2分)
(3)Cl2;湿润的碘化钾淀粉试纸;KClO3与Cr2O3 发生了氧化还原反应 (3分)
氧化铁、氧化铜、二氧化锰等都可作为KClO3受热分解的催化剂或氧化铁的催化能力和二氧化锰的催化能力较好。其他合理也给分(1分)
[典例精析]
专题一:化学实验基本操作与仪器
例1.下列仪器:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是
A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
[解析]①漏斗:用来过滤分离固液混合物;③蒸馏烧瓶:用于液体蒸馏,分离沸点相差较大的液态混合物;⑤分液漏斗:萃取分离互不相溶的液态混合物。
[答案]C
例2. 实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ②固定铁圈位置 ③放上蒸发皿 ④加热搅拌 ⑤停止加热、余热蒸干 其正确的操作顺序为
A.②③④⑤ B.①②③④⑤ C.②③①④⑤ D.②①③④⑤
[解析]本题属实验技能考查,考核溶液蒸发装置的安装,要求考生掌握正确操作顺序。
[答案]B
例3. 在一支25mL的酸式滴定管中盛入0.1mol/L的HCl溶液,其液面恰好在5mL刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/LNaOH溶液进行中和,则所需NaOH溶液的体积是
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
[解析]滴定管的刻度是上小下大,且在下端无刻度,再加上一段尖咀部分,同HCl溶液的体积大于25mL-5mL=20mL。
[答案]A
专题二:课本实验的整合与拓展(气体的制备)
例4.按下列实验方法制备气体,合理而又实用的是
A.锌粒与稀硝酸反应制备H2 B.向饱和氯化钠溶液中滴加稀硫酸制备HCl
C.亚硫酸钠与浓硫酸反应制备SO2 D.大理石与浓硫酸反应制备CO2
[解析]锌粒与硝酸反应不能制备H2,只能生成氮的氧化物;HCl气体是固体氯化钠与浓硫酸共热而制取;大理石与浓硫酸反应生成微溶的CaSO4,CaSO4覆盖在大理石上,而使反应实际上停止。
[答案]C
例5 下图是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是 (填正确选项的标号)
 A.铜屑和浓硝酸
B.二氧化锰和浓盐酸
A.铜屑和浓硝酸
B.二氧化锰和浓盐酸
C.电石和水 D.碳酸钙和稀盐酸
[解析]本题考查常见气体实验室的制取与干燥基础知识的掌握情况。能利用这套装置制得的气体需符合三个条件:固体与液体反应,反应不用加热;气体不与浓硫酸反应,可使用浓硫酸进行干燥;密度大于空气,可用向上排空气集气法收集。此外注意尾气的吸收,而铜屑与浓硝酸反应制取NO2没有;用碳酸钙与稀盐酸制CO2反应不需加热,CO2跟浓硫酸不反应且密度大于空气,可用这套装置。用MnO2跟浓盐酸反应需加热,电石跟水反应产生的乙炔密度比空气略小,均不符合题意。
[答案]D
例6 某无色混合气体可能含有CO2、CO、H2O(水蒸气)、H2中的一种或几种,依次进行如下连续处理(假定每步处理均反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清的石灰水时,溶液变得浑浊。由此可以确定混合气体中
A.一定含有CO2.H2O,至少含有H2.CO中的一种
B.一定含有H2O、CO,至少含有CO2.H2中的一种
C.一定含有CO、CO2,至少含有H2O、H2.中的一种
D.一定含有CO、H2,至少含有H2O、CO2中的一种
[解析]本题通过气体反应有关必然性和可能性的推断,着重考查思维的连续性和逻辑性。由①可知,碱石灰吸收的是CO2或H2O,或二者的混合物;②中CuO被还原为Cu,还原剂为CO或H2,或二者的混合物;但由③可知,反应②生成了H2O,故原混合气体中一定有H2;由反应④可知,反应②又生成了CO2,故原混合气体中一定有CO。
[答案]D
专题三:重要的定量、半定量实验专题
例7.(2009年福建卷)某研究性小组借助A-D的仪器装置完成有关实验
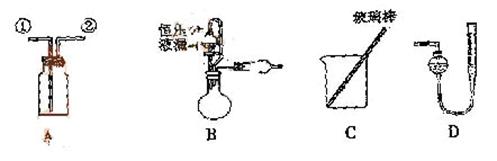
[实验一]收集NO气体。
(1) 用装置A收集NO气体,正确的操作上 (填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
[实验二]为了探究镀锌薄铁板上的锌的质量分数 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
(2)选用B和 (填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),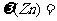 = 。
= 。
(4)计算镀层厚度,还需要检索的一个物理量是 。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
(6)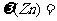 。
。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
[解析]本题考查实验的探究,涉及NO气体的收集,混合物中金属含量的计算等。(1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。排水时应用短进长出。(2)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。所以需要的装置有测H2的体积的D装置。(3)Zn与H2之间量为1:1,则n(Zn)=V/22.4 mol,w (Zn)=m(Zn)/m1 =  。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。(6)减少的质量即为Zn的质量。(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。(6)减少的质量即为Zn的质量。(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
[答案](1)C (2)D (3) (或
(或 等其他合理答案)(4)金属锌的密度(或其他合理答案)
等其他合理答案)(4)金属锌的密度(或其他合理答案)
(5)偏大 (6)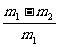 (或其他合理答案)
(7)劣于
(或其他合理答案)
(7)劣于
专题四 酸碱中和滴定
例8 草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL水溶液
(1)称25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:(1)实验中不需要的仪器有(填序号)_____,还缺少的仪器有(填名称)___________________。
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒球 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在________________式滴定管中,因为(3)
若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会__________________________(偏大、偏小、无影响)
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸________________________mol·L-1,由此可计算x的值是____________。
[解析]该题涉及到气化还原滴定,虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似。由于该反应有明显的颜色变化,故可不可用指示剂。
(1)c , f , j
还缺少铁架台(带滴定管夹),胶头滴管(定容时用)
(2)用酸式滴定管,因KMnO4溶液有强氧化性,能腐蚀橡皮管。
(3)无影 响。因当初所取的待测液的物质的量一定。
响。因当初所取的待测液的物质的量一定。
(4) 2KMnO4 ~ 5H2C2O4
2mol 5mol
aV×10-3mol 0.025×Cmol

H2C2O4·xH2O ~ H2C2O4 ~ xH2O
1mol 18xg

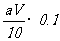


专题五:化学实验方案的设计与评价专题
例9.现有一定量含有Na2O杂质的Na2O2试样,请从下列仪器中选择适当的实验装置,设计实验,测定Na2O2的纯度(可供选择的反应物有CaCO3固体、6mol/L盐酸和蒸馏水)
|

(1)实验方案原理_________
(2)应选择的装置为(填图中仪器编号)_________
(3)所用装置的连接顺序为(填接口的字母,连接的胶管省略)______
[解析]测定含Na2O杂质的Na2O2的纯度,同学们一般都是从两种物质不同的性质着手。很多同学一看到Na2O2想到的就是它可以和CO2反应生成氧气,何况题目中提供了能生成CO2的试剂与仪器,然后可以通过测定氧气的体积推算出Na2O2的量,最终求算出其纯度。然而这条思路遇到的最大问题就是CO2也是气体,在通过横放的玻璃管与Na2O2反应不可能完全,那么接下去要处理的就是要将未完全反应的CO2处理掉,才能测氧气的体积,或者通过排水法量氧气体积时溶液必须是能很好吸收CO2的,这样遇到的问题就比较复杂了,违背了实验设计中的简约原则。其实,不受CO2这一信息的干扰,有更为简单的方法来测定Na2O2的量,即Na2O2与水反应。把握了这一基本思路后,这道题目也就迎刃而解了。
[答案](1)2Na2O2 +2H2O→4NaOH + O2↑ (2)⑤①④ (3)GBAF
例10. 以铜、硝酸、硝酸银、水、空气等为原料,可用多种方法制取Cu(NO3)2。
(1)试设计四种制取Cu(NO3)2的途径(用化学方程式表示)。
(2)从“绿色化学”角度(环境保护和经济效益)考虑,大量制取Cu(NO3)2最宜采用上述哪种方法?说明原因。
[解析]这是一道开放型的实验设计题目,答案是多样化的。从给出的原料和目标产物[Cu(NO3)2]来看,基本的思路如下:

完成这一转化的途径很多。
① 直接用Cu与HNO3反应:


② 利用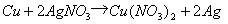
③  ,
,
问题(2)实际上是要求从环境保护和经济效益两个角度对上述四种制取Cu(NO3)2的方法进行评价。很显然,用Cu和HNO3直接反应的方法既污染环境(生成NO或NO2),又浪费原料(HNO3的理论利用率分别只有50%和75%),故不符合要求。用Cu和AgNO3,反应方法虽然简单,但是成本太高(AgNO3价格昂贵),也不符合题目要求。只有最后一种方法既不造成污染,两种基本原料为Cu和HNO3,又不会有损失,符合“绿色化学”的设计思想。
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;
假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是_______________________
(5)基于假设②,结论是___________________________________________,请设计实验进一步验证该结论,叙述实验操作:__________________________________。
[答案](1)碱性(2分)
ClO- + H2O
 HClO + OH- (2分)
HClO + OH- (2分)
(2)氧化性 漂白性 不稳定性 (任写两个,每空2分)
(3)CO2等酸性气体、光和热 (2分)
(4)铁钉表面出现铁锈(或红褐色固体) (2分)
(5)铁钉可能未被腐蚀,也可能被腐蚀但无明显现象 (2分) 用试管取出少量浸泡后的溶液,滴加足量的稀硫酸酸化,再滴加几滴KSCN溶液。
[方法要领](1)科学性的原则:所设计的实验应该符合科学道理,不能凭空捏造。
(2)对照性的原则:要设计一个对照性的实验,要想这个实验更能够说明问题,一定要有正反两个方面的实验。
(3)等量性的原则:所设计的实验中的平行反应,试剂的取用应该是等量的。
(4)单因子的变量原则:对某个实验的影响,会有很多的因素,实验正是要人为控制条件,使众多变量中,只能有一个因素是变量,其余几个是一样的。
7.新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2,请设计实验证明有O2生成。
。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布条褪色 |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①
② ③ ④H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色 实验②: 实验③: 实验④:把红色布条放在水里布条不褪色 |
|
 (3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
 H2CO3
H2CO3
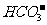 + H+
Ka1(H2CO3)=4.45×10-7
+ H+
Ka1(H2CO3)=4.45×10-7
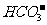 -
-
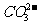 +H+
Ka2(HCO3-)=5.61×10-11
+H+
Ka2(HCO3-)=5.61×10-11
 HClO H++
HClO H++ Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中;
②氯气和碳酸钠按照1:1的比例恰好反应;
③将过量的氯气通入到少量的碳酸钠溶液中。
。
[答案](1)将盛满氯水的无色塑料瓶倒置在水槽中,光照一段时间后,有无色气体生成。(1分)将瓶子倒转过来,用带火星的木条插入瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气。
(2)[提出假设]①氯气使布条褪色(1分)②HClO使布条褪色(1分)③盐酸使布条褪色(1分)
[验证假设] ②把红色布条伸入氯水中,红色布条褪色(1分)
③把红色布条伸入稀盐酸中,红色布条不褪色(1分)[得出结论]次氯酸使布条褪色(1分)
(3)①Cl2+2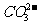 -+H2O==2
-+H2O==2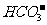 +
+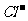 +
+ (1分)
(1分)
②Cl2+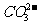 +H2O==
+H2O==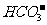 -+
-+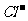 -+HClO(1分)
-+HClO(1分)
③2Cl2+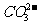 +H2O==CO2↑+2
+H2O==CO2↑+2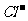 +2HClO(1分)
+2HClO(1分)
该消毒液对碳钢制品是否有腐蚀作用?
4. (山东省威海市2009届高三高考模拟)碳是形成化合物最多的元素,其单质与化合物广布于自然界。
(1)碳原子的核外电子排布式为 。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是 ;
 (2)CS2是一种重要的有机溶剂,CS2分子的空间构型为
;写出一种与CS2互为等电子体的物质的化学式
;
(2)CS2是一种重要的有机溶剂,CS2分子的空间构型为
;写出一种与CS2互为等电子体的物质的化学式
;
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如右图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有 个水分子,冰晶胞与金刚石晶胞微粒排列方式相同的原因是 。
[解析](1)N原子2p轨道半充满,能量低;(2)CS2分子与CO2互为等电子体,结构为直线型。(3)均摊法计算即可。
[答案](1)1s22s22p2 ,N原子2p轨道半充满,能量低 (2)直线形 CO2
(3)8 氢键具有方向性,每个水分子与相邻的4个水分子形成氢键
5.(2009年高考押题卷山东卷)有主族元素A、B、C、D四种元素,原子序数依次递增,A元素原子2p轨道上有2个未成对电子。B原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D原子得一个电子填入3p轨道后,3p轨道已充满。
请回答下列问题:
(1)AC2分子中含有____根π键,属于__________分子(填“极性分子”或“非极性分子”)
(2) B的氢化物的空间构型为_________,B原子的原子轨道采用______杂化,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________。
(3)写出A的常见氧化物与B的氧化物中互为等电子体的一组___________
(4)C元素的电负性_______D元素的电负性(填“>”,“<”或“=”);用一个化学方程式表示__________________________________
[解析]由题A元素原子的价电子排布为1s22s22p2或1s22s22p4,可能为碳或氧。B原子的价电子排布式为ns2np3,为VA族元素,由B的氢化物的溶解度可知B为氮元素,则A为碳。最高正价和最低负价之中为4,则为VIA族元素,为硫。D元素得1个电子后,3p轨道充满,说明价电子排布为s23p5,为氯元素。(1)CS2的结构式为S=C=S,含有2根π键,直线形,非极性分子。(2)NH3分子中N原子的原子轨道发生sp3杂化,其中一个杂化轨道为孤对电子占有,空间构型为三角锥形。(3)碳元素的常见氧化有CO和CO2,与氮的氧化物互为等电子体的有N2O。(4)硫、氯同周期,同周期元素电负性,随原子序数的递增而增大,所以电负性,C<D。
[答案] (1)2 非极性 (2) (3)三角锥形sp3 氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高 (4)CO2和N2O (5)< H2S +Cl2 =2HCl十S↓
21世纪教育网
3.(山东庆云一中2009年高考考前热身训练)目前,全世界镍(Ni)的消费量仅次于铜、铝、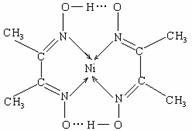 铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。
铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)某配合物结构如右图所示,分子内含有的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
 (3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③ ④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③ ④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序 号),预测HCHO分子的立体结构为
形。
号),预测HCHO分子的立体结构为
形。
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是 。
[解析](1)根据其物理性质可以判断为分子晶体;Ni为28号元素,所以基态Ni原子的电子排布式为1s22s22p63s23p63d84s2或[Ar] 3d84s2;(3)平面结构的中心原子为sp2杂化,所以选①③④;(4)根据均摊法计算即可;
[答案](1)分子、1s22s22p63s23p63d84s2或[Ar] 3d84s2 (2)ACE
(3)①③④、平面三角 (4)LaNi5或Ni5La
2.(银川一中2009届高三年级第四次月考理综)
元素A-D是元素周期表中短周期的四种元素,请根据表中的信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
物质或结构信息 |
单质制成的的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 |
单质常温、常压下是气体,原子的L层有一个未成对的 电子 电子 |
+2价阳离子的核外电子排布与氖原子相同。 |
(1)上表中与A属于同一周期的元素是_____________(写元素符号) ,写出D离子的电子排布式______________________。
(2)D和C形成的化合物属于_________晶体 。写出C单质与水反应的化学方程式_________________________ 。
(3)对元素B的单质或化合物描述正确的是_________。
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是(写元素符号)__ ___。 写出能证明该结论的一个实验事实___________ _____。
[解析]A单质制成的的高压灯,发出的黄光透雾力强、射程远。A为Na;B工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构,B可能为N或O; C单质常温、常压下是气体,原子的L层有一个未成对的 电子,C为F;D+2价阳离子的核外电子排布与氖原子相同,D为Mg。
电子,C为F;D+2价阳离子的核外电子排布与氖原子相同,D为Mg。
[答案](1)Mg;
1s22s22s6。 (2)离子; 2F2+2H2O 4HF+O2.
4HF+O2.
(3)b;d(B是氧气或氮气)。
(4)Na;钠与水反应比镁与水反应激烈或氢氧化钠的碱性比氢氧化镁强
1.(天津市汉沽一中2008-2009学年度高三第四次月考)
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧(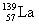 ) 和镍(
) 和镍( ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
 E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)

[解析](1)根据晶胞可以得到储氢材料的化学式为:LaNi5;(2)A中储氢材料中不存在共价键,不属于原子晶体;B中此过程吸热;D中氢气分子间不存在氢键;
[答案](1)LaNi5 + 3H2  LaNi5H6;(2)CE(3)①[Ar]3d7;或
LaNi5H6;(2)CE(3)①[Ar]3d7;或
②2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;
(4)A和B(或A和C、A和D、B和E、C和E、D和E任一组均可);
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com