
3. (08北京卷)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核,通常状况下,W为无色液体,已知:X+Y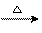 Z+W。
Z+W。
(1)Y的电子式是_______________________。
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a. 向广口瓶内注入足量热NaOH溶液,将盛有Cu片的小烧杯放入瓶中。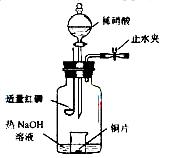
b. 关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞
c. 待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要实验操作是_______________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是_________________。
③步骤c滴入稀硝酸后烧杯中的现象是___________________________________。反应的离子方程式是________________________________________。
(4)一定温度下,将1molN2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色,温度继续由T1升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化如图所示。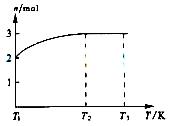
①温度在T1-T2之间,反应的化学方程式是___________________________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留一位小数) _______________________21世纪教育网
[答案]

[解析]X、Y、Z、W含有相同电子数的分子或离子,其组成元素的序数均小于10,X有5个原子核,为CH4或NH4+,通常状况下,W为无色液体,为H2O;根据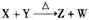 ,可知X为NH4+,Y为OH-,Z为NH3;故Y的电子式为:
,可知X为NH4+,Y为OH-,Z为NH3;故Y的电子式为: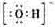 ,液氨电离和水相似,其电离式为:2NH3(l)=NH4++NH2-;用图示装置制备NO并验证其还原性,故整个操作中没有验证步骤,可以在制备到NO后,通入少量氧气,通过现象变化确定其还原性,故在c步骤中增加,打开止水夹,通入少量氧气;红磷充分燃烧生成P2O5,其余氢氧化钠反应为: P2O5+6OH-=2PO43-+3H2O,步骤c滴入硝酸后的现象为:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,反应为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O;1molN2O4置于密闭容器中,升温过程中,逐渐转变为红棕色,说明N2O4=2NO2,此时装置中为2molNO2,根据图像中表示的意义,继续加压时,气体的物质的量增多,且为无色,超T2温度后,物质的量约为3mol,故其反应式为:2NO2=O2+2NO,其相对分子质量为:30.721世纪教育网
,液氨电离和水相似,其电离式为:2NH3(l)=NH4++NH2-;用图示装置制备NO并验证其还原性,故整个操作中没有验证步骤,可以在制备到NO后,通入少量氧气,通过现象变化确定其还原性,故在c步骤中增加,打开止水夹,通入少量氧气;红磷充分燃烧生成P2O5,其余氢氧化钠反应为: P2O5+6OH-=2PO43-+3H2O,步骤c滴入硝酸后的现象为:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,反应为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O;1molN2O4置于密闭容器中,升温过程中,逐渐转变为红棕色,说明N2O4=2NO2,此时装置中为2molNO2,根据图像中表示的意义,继续加压时,气体的物质的量增多,且为无色,超T2温度后,物质的量约为3mol,故其反应式为:2NO2=O2+2NO,其相对分子质量为:30.721世纪教育网
[考点分析]微粒结构、电子式书写、实验基本操作、离子方程式书写等知识
21世纪教育网
2. BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知①在BGO中锗处于其最高价态;②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构;③BGO可以看作是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋两种元素的符号分别是:_______和_______
(2)BGO晶体的化学式是:_______
(3)BGO晶体中所含铋氧化物的化学式是:_______
[答案](1)Ge和Bi
(2)Bi4Ge3O12或2Bi2O3.3GeO2、Bi4(GeO4)3
(3)Bi2O3
[解析]首先从记忆中提取锗、铋的元素符号,锗属于ⅣA族,其最高价氧化物为GeO2;铋是ⅤA族元素,其常见化合价为+3;+5,铋具有最外层8电子稳定结构的氯化物只能是BiCl3,相应的氧化物为Bi2O3。BGO的组成为mBi2O3.nGeO2,根据两种氧化物所含氧的总质量相同,可以确定m、n的值。然后遵循书写复杂氧化物的规则。
[考点分析]本题以新材料为背景,考查学生自学能力和思维的综合性,考查了元素名称、元素符号、元素常见化合价、原子结构等多个知识点。
1.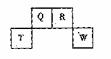 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______.
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的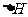 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
[答案]
(1) (2)弱于
(2)弱于
(3)S + 2H2SO4(浓)  3SO2↑+ 2H2O
3SO2↑+ 2H2O
(4)2H2O2 MnO22H2O + O2↑(或其他合理答案)
(5)NaNO2
(6)(3a – 4b)KJ/mol
[解析]结合题目信息,结合T在周期表的位置与族序数相等这一条件 ,可以得出T为Al,Q为C,R为N,W为S。(1)T为Al,13号元素。(2)根据S、C最高价氧化物对应的酸性硫酸强于碳酸,则可得非金属性S强于C。(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。(5)N中相对分子质量最小的氧化物为NO,2NO + O2
= 2NO2,显然NO过量1L,同时生成1L的NO2,再用NaOH吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3N的化合物NaNO2。(6)C + O2  CO2 △H= -a KJ/mol①,4Al +3 O2
=2Al2O3 △H= -4bKJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al +
3CO2
CO2 △H= -a KJ/mol①,4Al +3 O2
=2Al2O3 △H= -4bKJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al +
3CO2 3C + 2Al2O3,此反应的H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)KJ/mol21世纪教育网
3C + 2Al2O3,此反应的H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)KJ/mol21世纪教育网
[考点分析]无机物的性质、化学用语、化学方程式书写、氧化还原反应以及热化学有关计算
28. 下列与胶体性质或用途无关的事实是 ( )
①MgCl2能用于止血; ②硅胶能用作吸附剂; ③明矾用于净水; ④在陶瓷、聚合物等材料中加入固态胶体粒子; ⑤药皂里加苯酚能消毒; ⑥三氯化铁溶液中加入氢氧化钠溶液出现红褐色沉淀; ⑦KMnO4溶液通电时阴极区溶液颜色变浅,阳极区溶液颜色加深
A.①②④ B.③⑤⑥ C.④⑤⑥ D.⑤⑥⑦
[答案]D
[专题综合]
27. 下列叙述正确的是 ( )
A.二氧化硅是人类将太阳能转换为电能的常用材料
B.二氧化硫在接触室被氧化成三氧化硫,再在吸收塔内用水吸收制成浓硫酸
C.为检验酸性溶液中的Cl-和SO42-,先加BaCl2溶液,滤去沉淀后再加AgNO3溶液
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
[答案]D
26. 下列关于某些物质的检验方法正确的是 ( )
A.利用Ba(OH)2鉴别Na2CO3溶液和NaHCO3溶液
B.用焰色反应鉴别NaCl、KCl和Na2SO4三种物质
C.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D.通过向瓶中加入适量水观察溶液颜色变化证明一瓶气体是溴蒸气还是二氧化氮
[答案]CD
25. “神舟七号”,标志我国已具有深太空探测能力。据科学家预测,月球的土壤中吸附着数百万吨的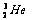 ,每百吨
,每百吨 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以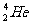 的形式存在。下列说法正确的是
( )
的形式存在。下列说法正确的是
( )
A.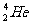 原子核内含有4个质子
B.
原子核内含有4个质子
B. 和
和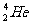 互为同位素
互为同位素
C. 原子核内含有3个中子
D.
原子核内含有3个中子
D.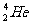 比
比 多1个电子
多1个电子
[答案]B
24. 符合右图中阴影部分的物质是 ( )
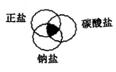 A.Na2CO3 B.Cu2(OH)2CO3
A.Na2CO3 B.Cu2(OH)2CO3
C.NaCl D.NaHCO3
[答案]A
23. 下列各组物质中,第一种是含氧酸,第二种是混合物,第三种是碱的是 ( )
A.爆鸣气、硫酸铜、硫酸 B.水、空气、纯碱
C.氧化铁、胆矾、熟石灰 D.硝酸、石灰石、烧碱
[答案]D
22. 下列说法正确的是 ( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.洒精、硫酸钡和水分别属于电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
[答案]D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com