
3. 解答离子共存的选择题,首先要看清题干要求:一是判断离子共存,还是判断不共存;二要看题目中的隐含条件:碱性、酸性、无色透明、pH为多大;三看离子间是否发生氧化还原反应、复分解反应等。总之,要注意审清题意,充分挖掘出题设的隐含条件;要把离子自身的特点同题干中给定的限制条件结合起来分析。
1. 离子方程式正误判断主要抓住二个原则,一是符号书写是否正确,包括:①原理是否正确②化学式与离子形式拆合是否正确,二是是否守恒,包括原子守恒、电荷守恒,氧化还原反应还要转移电子守恒。
离子方程式的判断正误类型的题目,可总结为“八查”: (1)一查反应是否符合客观事实 如钠投入CuSO4溶液中:
2Na+Cu2+=2Na++Cu (×) 2Na+Cu2++2H2O= 2Na++Cu(OH)2↓+H2↑(√)
(2)二查质量是否守恒、电荷是否守恒、得失电子是否守恒 如Fe2++Cl2=Fe3++2Cl- (×) 2Fe2++Cl2=2Fe3++2Cl-(√)
(3)三查化学符号(↑、↓、=、 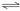 、化学式、离子形式)使用是否正确,如碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑(×) HCO3-+H+=H2O+CO2↑(√)
、化学式、离子形式)使用是否正确,如碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑(×) HCO3-+H+=H2O+CO2↑(√)
(4)四查是否忽略隐含的离子反应 如CuSO4溶液和Ba(OH)2溶液反应:Ba2++SO42-=BaSO4↓(×)
Cu2++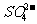 +Ba2++2OH-=Cu(OH)2↓+BaSO4↓(√)
(5)五查阴、阳离子配比是否正确
如稀H2SO4和Ba(OH)2溶液反应:H++SO42-+OH-+Ba2+=BaSO4↓+H2O (×)
+Ba2++2OH-=Cu(OH)2↓+BaSO4↓(√)
(5)五查阴、阳离子配比是否正确
如稀H2SO4和Ba(OH)2溶液反应:H++SO42-+OH-+Ba2+=BaSO4↓+H2O (×)
2H++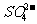 +2OH-+Ba2+=BaSO4↓+2H2O(√)
(6)六查反应物用量与其反应是否一致。如碳酸氢钙溶液中加入少量氢氧化钠:
Ca2++2
+2OH-+Ba2+=BaSO4↓+2H2O(√)
(6)六查反应物用量与其反应是否一致。如碳酸氢钙溶液中加入少量氢氧化钠:
Ca2++2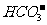 +2
+2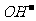 =CaCO3↓+
=CaCO3↓+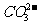 +2H2O(×)
+2H2O(×)
Ca2++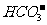 +
+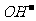 =CaCO3↓+H2O (√)
(7)七查加入试剂顺序与其反应是否一致。如往Na2CO3溶液中滴入少量稀盐酸:
2H++
=CaCO3↓+H2O (√)
(7)七查加入试剂顺序与其反应是否一致。如往Na2CO3溶液中滴入少量稀盐酸:
2H++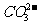 =H2O+CO2↑(×) H++
=H2O+CO2↑(×) H++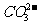 =
=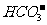 (√)
(8)八查反应条件与其反应是否一致。如往氯化铵溶液中滴入烧碱溶液:
(√)
(8)八查反应条件与其反应是否一致。如往氯化铵溶液中滴入烧碱溶液:
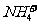 +
+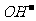 =NH3↑+H2O (×)
=NH3↑+H2O (×) 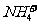 +
+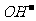
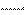 NH3·H2O (√)
2. 离子方程式正误判断型试题,所给离子方程式常见的错误有:①不能正确使用化学式与离
NH3·H2O (√)
2. 离子方程式正误判断型试题,所给离子方程式常见的错误有:①不能正确使用化学式与离
子符号;②反应前后电荷不守恒;③反应原理不正确或反应不符合实际;④忽略反应物相对量的影响。
要注意几个特殊问题:
①离子反应不但可以发生在离子与离子间,也可以发生在离子与原子、离子与分子之间。如:Fe+2H+===Fe2++H2↑,C12+2I-===2Cl-+I2。
②有些反应从离子方程式看,好像没有离子参加,但实际上却是离子反应。如2Na+2H2O===2Na++2OH-+H2↑,实质是钠与水电离出的H+反应,只不过因为水是难电离的,要保留化学式
③相同物质之间的化学反应,在一种条件下是离子反应,在另一种条件下就不一定是离子反应,如:21世纪教育网
HCl(aq)+NH3(aq)===NH4C1(aq)离子反应 HCl(g)+NH3(g)===NH4Cl(s)分子反应
④复分解型离子反应因生成难溶物质、难电离的物质或挥发性物质,均使溶液中自由移动的离子数目减少,但这仅是一般规律,并不是绝对的。如以下反应中:CH3COOH+NH3·H2O===NH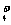 +
+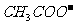 +H2O,自由移动的离子数目反而增加。
+H2O,自由移动的离子数目反而增加。
14. 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2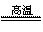 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
13. 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
[答案]B
[解析]由于Fe2+的还原性强于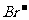 ,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化
,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化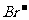 。2Fe2+ + Cl2
。2Fe2+ + Cl2
 2Fe3+ + 2
2Fe3+ + 2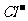 ,2
,2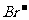 + Cl2
+ Cl2  Br2 + 2
Br2 + 2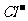 ,2FeBr2 + 3Cl2
,2FeBr2 + 3Cl2  2FeCl3 + 2Br2 。当x/a
≤0.5时,Cl2仅氧化Fe2+,故A项正确21世纪教育网
2FeCl3 + 2Br2 。当x/a
≤0.5时,Cl2仅氧化Fe2+,故A项正确21世纪教育网
当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;
当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
[考点分析]氧化性强弱比较氧化还原反应的相关计算21世纪教育网
12. 一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
[答案]B
[解析]此题类型属于信息给予题,据题意并结合提示,H2C2O4为二元弱酸,可写出氢氧化钠与KHC2O4·H2C2O4·2H2O反应的方程式:
6NaOH+2KHC2O4·H2C2O4·2H2O=3Na2C2O4+K2C2O4+8H2O;
10[KHC2O4·H2C2O4]+8KMnO4+ 17H2SO4=8MnSO4+9K2SO4+40CO2+32H2O 。可得关系式:6NaOH~2KHC2O4·H2C2O4·2H2O,10[KHC2O4·H2C2O4]~8KMnO4 ;综合以上两式可得:15NaOH ~ 4KMnO4 , 结合题意:V(NaOH)=3V(KMnO4)可得出关系:
15NaOH ~ 4KMnO4
15 4
3V(KMnO4)×0.1000mol·L-1 V(KMnO4)×c(KMnO4)
列式得:15×V(KMnO4)×c(KMnO4)=4×3V(KMnO4)×0.1000mol·L-1,整理得:0.08000mol·L-1,答案选B。
[考点分析]氧化还原反应的滴定
11. 2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8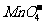 +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
6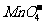 +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:

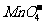 +
+ Fe2++
Fe2++ H+
H+ Mn2++
Mn2++ Fe3++
Fe3++ H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________ g。
(4)混合物中Cu2S的质量分数为_________。
[答案](1)1 5 8 1 5 4 (2)0.007 (3)19.6 (4)40%
[解析]根据配平后的离子方程式,KMnO4-5(NH4)2Fe(SO4)2,则剩余KMnO4的物质的量为: =0.07 mol。
=0.07 mol。
需称量固体的质量为:0.5 L×0.1 mol·L-1×392 g·mol-1=19.6 g21世纪教育网
假设混合物中Cu2S的物质的量为x,CuS的物质的量为y,结合以上数据列出方程组:
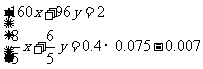 ,解得结果
,解得结果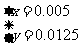 ,则混合物中Cu2S的质量分数为:
,则混合物中Cu2S的质量分数为: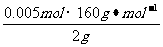 ×100%=40%。
×100%=40%。
[考点分析]氧化还原反应的配平及综合计算
10. a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g
②(a+b)×189 g ③(a+b)mol ④(Vc-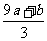 )mol
)mol
A.①④ B.②③
C.①③ D.②④
[答案]D
[解析]由元素守恒知:未被还原的硝酸将转化为Fe(NO3)3中的 ,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n(Fe(NO3)3)=n(Fe)=(a+b) mol,所以未被还原的硝酸的质量=3 (a+b) mol×63 g·mol-1=(a+b)×189 g,②正确;又根据化合价升降守恒知
,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n(Fe(NO3)3)=n(Fe)=(a+b) mol,所以未被还原的硝酸的质量=3 (a+b) mol×63 g·mol-1=(a+b)×189 g,②正确;又根据化合价升降守恒知
a mol 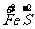 →a mol
→a mol 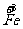 (NO3)3+a mol
(NO3)3+a mol 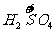 升高(3-2)a+(6+2)a=9a mol
升高(3-2)a+(6+2)a=9a mol
b mol 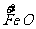 →b mol
→b mol 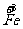 (NO3)3 升高(3-2)b=b mol
(NO3)3 升高(3-2)b=b mol
x mol H 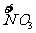 →x mol
→x mol 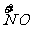 降低(5-2)x
mol=3x mol
降低(5-2)x
mol=3x mol
得9a mol+b mol=3x mol,即显氧化性的硝酸的物质的量x=(9a+b)/3 mol,所以未被还原的硝酸为(Vc-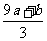 )mol,④正确21世纪教育网
)mol,④正确21世纪教育网
[考点分析]本题以元素化合物知识为载体,考查守恒法技巧。
9. 一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-=== 2Fe2+。据此,回答下列问题:
⑴将反应Zn+2H+ === Zn2++H2↑拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑵将反应3NO2+H2O == 2H++2NO3-+NO拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑶已知某反应的两个“半反应式”为:CH4+10 OH--8e-===CO32-+7H2O,O2+2H2O+4e-=== 4OH-,则氧化还原反应方程式为 。
[答案]⑴Zn-2e-=== Zn2+,2 H++2e-=== H2 。
⑵2NO2+2H2O-2e-=== 4H++2 NO3-;NO2+2 H++2e-=== NO+H2O
⑶CH4+2O2+2OH-=== CO32-+3H2O
[解析]⑵注意电子得失守恒、粒子数目守恒以及物质的选择与系数调整。在反应3NO2+H2O ===2 H++2 NO3-+NO中,只有1个NO2分子作氧化剂,有2个NO2分子作还原剂。2个NO2分子变为2个NO3-离子时,需2个H2O分子提供2个O原子,2个 H2O分子中的4个H原子则变为4个 H+离子。1个NO2分子变成1个NO分子时,另1个O原子需要与2个 H+离子结合成水。所以,有以上“半反应”。⑶前式 + 后式×2即得
[考点分析]氧化还原反应理解21世纪教育网
8. 氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
[答案]B
[解析]该反应中 N2降价为氧化剂,C升价为还原剂,每生成1molAlN转移3mol电子,AlN中Al为+3价,N为-3价。D中摩尔质量的单位为g/mol。
[考点分析]氧化还原相关概念的辨析和计算能力
7. 从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2 +12H2O====7Cu2S+5FeSO4 +12H2SO4。下列说法正确的是 ( )
A. Cu2S既是氧化产物又是还原产物
B. 5 mol FeS2发生反应,有10 mol电子转移
C. 产物中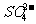 有一部分是氧化产物
有一部分是氧化产物
D. FeS2只作还原剂
[答案]C
[解析]分析反应

可知,FeS2中S的化合价降低生成Cu2S,升高生成FeSO4,故FeS2既是氧化剂又是还原剂,D错误;CuSO4中Cu的化合价降低生成Cu2S,FeS2中S的化合价也降低生成Cu2S,故Cu2S只是还原产物,非氧化产物,A错误;5
mol FeS2发生反应,有21 mol 电子转移,B错误;产物中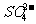 有一部分是氧化产物,另一部分由CuSO4提供,C正确。
有一部分是氧化产物,另一部分由CuSO4提供,C正确。
[考点分析]考查学生对氧化还原相关概念的辨析和计算能力21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com