
7. 根据热化学方程式:S(g)+O2(g)=SO2(g);△H= -297.23kJ/mol。下列说法中正确的是 ( )
A.S(g)+O2(g)=SO2(l); |△H|>297. 3kJ/mol
B.S(g)+O2(g)=SO2(l);|△H|<297. 3kJ/mol
C.1mol SO2的键能总和小于1mol S和1mol O2键能之和
D.1mol SO2的键能总和等于1mol S和1mol O2键能之和
[答案]A
6. 在25℃、1.01×105Pa下,将22 g CO2通入1 mol·L-1NaOH溶液750mL中充分反应,测得反应放出x kJ热量。在该条件上,1 mol CO2通入2 mol·L-1NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是 ( )
A.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(4x-y) kJ·mol-1
D.2CO2(g)+NaOH(1) === NaHCO3(1);△H=-(8x-2y) kJ·mol-1
[答案]C
5. 下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.已知C(石墨,s)=== C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)==2CO2(g);△H1。2C(s)+O2(g)=2CO(g);△H2。则△H1>△H2
[答案]C
4. 已知下列反应的热化学方程式为:⑴C(s)+O2(g)=CO2(g) ;ΔH 1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ;ΔH 2=-870.3kJ/mol
⑶H2(g)+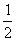 O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的ΔH 为
A.488.3 kJ/mol B.-488.3 kJ/mol C.-244.15 kJ/mol D.244.15 kJ/mol
[答案]B
3. 下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是 A.1/2H2(g)+ 1/2Cl2(g)= HCl(g);△H=-92.3kJ/mol
B.CH4(g)+ 2O2(g)= CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+ O2(g)= 2H2O(l);△H=-571.6kJ/mol
D.CO(g)+ 1/2O2(g)= CO2(g);△H=-283kJ/mol
[答案]D
2. 下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g) == 2H2O(l);△H=-571.6kJ·mol-1,则氢气的燃烧热为285.8kJ·mol-1
B.已知C(石墨,s)== C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:
NaOH(aq)+CH3COOH(aq) == CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
[答案]A
1. 下列说法或表示方法正确的是
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量就是中和热
C.由石墨比金刚石稳定可知:
D.在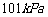 、
、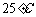 时,
时, 完全燃烧生成气态水,放出
完全燃烧生成气态水,放出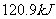 热量,则氢气的燃烧热为241.8
热量,则氢气的燃烧热为241.8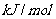
[答案]C
12.(09年福建理综·23)
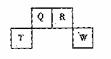 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为 。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的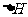 =
(注:题中所设单质均为最稳定单质)。
=
(注:题中所设单质均为最稳定单质)。
[答案](1) (2)弱于
(2)弱于
(3)S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
(4)2H2O2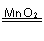
 2H2O+O2↑(或其他合理答案:)
2H2O+O2↑(或其他合理答案:)
(5)NaNO2
(6)(3a – 4b)kJ/mol
[解析]从给出的表,结合T在周期表的位置与族数相等这一条件 ,不难得出T为Al,Q为C,R为N,W为S。(1)T为Al,13号元素。(2)S、C最高价氧化物对应的酸为硫酸强于碳酸,则可得非金属性S强于C。(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。(5)N中相对分子质量最小的氧化物为NO,2NO+O2=2NO2,显然NO过量1L,同时生成1L的NO2,再用NaOH吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3N的化合物NaNO2。(6)C +O2 CO2△H=-a
kJ/mol①,4Al+3O2=2Al2O3△H= -4bkJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2
CO2△H=-a
kJ/mol①,4Al+3O2=2Al2O3△H= -4bkJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2 3C+2Al2O3,此反应的△H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)kJ/mol
3C+2Al2O3,此反应的△H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)kJ/mol
[考点分析]本题考查无机物的性质,涉及化学用语、方程式书写、氧化还原反应以及热化学的知识21世纪教育网
[专题突破]
11.(09年江苏化学·17)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+O2(g)=H2O(l) △H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率(×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
[答案](1)BD
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ.mol-1
(3)H2O2分解速率加快
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
[解析](1)有关环保的比较容易。(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。(4)根据题目条件书写离子方程式常规题。
[考点分析]本题考察的知识比较散,一道题考察了几个知识点。覆盖面比较多。但盖斯定律,热化学方程式,离子方程式都是重点内容
10.(08四川卷)下列关于热化学反应的描述中正确的是 ( )
A.HCl和NaOH反映的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
[答案]B
[解析与评价]选项A中中和热是指在一定条件下强酸于强碱的稀溶液反应生成1molH2O所放出的热量,与酸和碱的元数无关;选项C中加热是化学反应的条件,与反应是为否放热和吸热无关,如:Fe+S FeS,它属于放热反应;选项D中燃烧热是指1mol的物质完全燃烧生成稳定的化合物所放出的热量,这里的稳定化合物包含两层意思,一是化合物稳定,如C燃烧可生成CO和CO2,其中CO2比CO稳定,二是化合物的状态稳定,如气态的水就不如液态的水稳定。
FeS,它属于放热反应;选项D中燃烧热是指1mol的物质完全燃烧生成稳定的化合物所放出的热量,这里的稳定化合物包含两层意思,一是化合物稳定,如C燃烧可生成CO和CO2,其中CO2比CO稳定,二是化合物的状态稳定,如气态的水就不如液态的水稳定。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com