
1.(08全国Ⅱ卷)Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,
(1)Q的最高价氧化物,其固体属于________晶体,俗名叫_____________。
(2)R的氢化物的分子的空间构型是_____________,属于____________分子(填“极性”或“非极性”),它与X形成的化合物可作为一种重要陶瓷材料,其化学式是___________。
(3)X的常见氢化物的空间构型是____________;它的另一种氢化物X2H4是一种火箭燃料的成分,其电子式是__________。
(4)Q分别与Y、Z形成的共价化合物的化学式是_______和_______;Q与Y形成的分子的电子式是____________,属于______________分子(填“极性”或“非极性”)。
[解析]Q的低价氧化物与X单质分子的电子总数相等,Q可能为C(碳),X为N,由于这五种元素均是前20号元素,所以R为Si,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z,Y为S,Z为Cl。
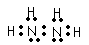 [答案](1)分子;干冰。
[答案](1)分子;干冰。
(2)正四面体;非极性;Si3N4。
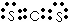 (3)三角锥;
。
(3)三角锥;
。
(4)CS2;CCl4。 ;非极性。
13. A、B、C、D、E、F为原子序数依次增大的主族元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3。回答:
(1)写出下列元素的符号:A________、D________、E________;
(2)用电子式写出B、F形成的化合物的电子式___________________;(3)A、C两种元素最高价氧化物的水化物反应的离子方程式为__________________________;(4)D的固态氧化物是_______晶体,含n molD的氧化物的晶体中含D-O共价键为_______mol。
[答案](1)Na、Si、P;(2)氯化镁电子式略;(3)Al(OH)3+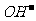
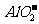 +2H2O;(4)原子,4n
+2H2O;(4)原子,4n
[专题综合]
12. 有A、B、C、D四种相邻短周期元素(如下图所示),根据元素性质递变规律,回答下列问题:
⑴A和C元素;B和D元素各有相似的化学性质,是因为:
。
⑵氧与硫处于同一族,性质相似,对应的化合物也有类似的性质,同时有差异,如:H2O与H2S; CH3CH2OH与CH3CH2SH(乙硫醇)等有一定相似性。请回答下列问题:
① 已知酸性H2O<H2S,试判断乙醇和乙硫醇分别与金属钠反应的剧烈程度
CH3CH2OH CH3CH2SH(填>、<或=)
②CH3CH2Br不仅能与NaOH溶液反应,而且也能与NaHS溶液反应,则化学反应方程式为:
⑶在四种元素中A元素还可能与D元素有相似的化学性质,化学上称为对角线规则。请完成下列反应方程式:(已知:镁可以在氮气中燃烧得到氮化镁)
①Li单质也能在氮气中燃烧,其化学反应方程式为: 。
②铍单质与氢氧化钠溶液反应的离子方程式为: 。
[答案](1)同主族元素原子的结构相似,元素的化学性质相似
⑵①<
②CH3CH2Br+ NaHS= CH3CH2SH+ NaBr
⑶①6Li+N2==2Li3N(3分)②Be+2OH-==BeO22-+H2↑
11. 现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
焰色反应显黄色 |
|
X |
最高价氧化物对应的水化物与其氢化物化合生成盐 |
|
Y |
单质在通常状况下为淡黄色固体 |
|
Z |
原子核外电子排布式为1s22s22p63s23p1 |
(1)T原子中核外电子的运动状态共有______种,焰色反应是 变化(选填“化学”或“物理”)。
(2)X的气态氢化物的电子式为__________ ,最高价氧化物对应的水化物与其氢化物化合生成的盐在实际应用中可以作 。
(3)元素Y的最高氧化物对应的水化物其浓溶液有三大特性为 、
、 。
(4)工业上制备Z所用的方法是 。
[答案]
(1)11 物理 (2) 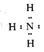 化肥、炸药 (3)吸水性、脱水性、强氧化性
化肥、炸药 (3)吸水性、脱水性、强氧化性
(4)电解法
10. 有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A的一种核素的原子核为质子,B原子的最外层电子数是次外层电子数的2倍。B原子的最外层电子数是D、E原子最外层电子数之和,C原子的最外层电子数是D、F原子最外层电子数之和。下列推论正确的是 ( )
A.A、B两元素只能形成一种化合物
B.D、E两元素的最高价多种氧化物对应的水化物均为强碱
C.C的气态氢化物的稳定性一定小于F的气态氢化物
D.C、F两种元素可能形成原子晶体型的新型无机非金属材料
[答案]D
9. 甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,
,满足条件的甲和乙为 ( )
甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,
,满足条件的甲和乙为 ( )
A.铝和铁 B.氟气和氧气 C.碳和硅 D.镁和碳
[答案]D
8. 下列事实能说明氯的非金属性比硫强的是 ( )
A.铁与硫反应生成硫化亚铁,而铁与氯气反应时生成氯化铁
B.与金属钠反应,氯原子得一个电子,而硫原子能得两个电子
C.常温时氯气呈气态,而硫呈现固态
D.氯的最高价为+7价,而硫的最高价为+6价
[答案]A
7. 下列各组物质的性质比较,正确的是
A.酸性:HClO4>H3PO4>H2SO4 B.氢化物稳定性:H2S>HF>H2O
C.碱性:NaOH>Mg(OH)2>Ca(OH)2 D.氧化性:F2 > Cl2 > Br2 > I2
[答案]D
6. 已知反应 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是
A. 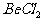 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B.  溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C. 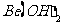 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D. 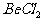 水溶液的导电性强,因此
水溶液的导电性强,因此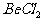 一定是离子化合物
一定是离子化合物
[答案]AC
5. 短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是( )
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
[答案]BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com