
12. 在一个固定容积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)≒3C(g)+D(g),达到平衡时C的浓度为cmol/L,若维持容器的容积和温度不变,按下列4种配比作为起始物质,达到平衡时C的浓度仍为cmol/L的是 ( )
A. 4molA+2molB B.1molA+0.5molB+1.5molC+1molD
C. 2molC+1molD+1molB D.3molC+1molD
[答案]D
[解析]由“达到平衡时,C的浓度仍为cmol/L”应想到等效平衡问题,然后再根据题中“容器的容积和温度不变”及反应方程式可知应从等温、等容条件下的等效平衡(即第1类等效)角度进行判断,因此A项不符题意,而对于B、C、D选项来说按照“一边归零”的方法,把初始状态的1molA+0.5molB+1.5molC+1molD、 2molC+1molD+1molB 、3molC+1molD可分别转变为2molA+1molB+0.5molD、(4/3)molA+(5/3)molB+(1/3)molD、2molA+1molB,故知D项正确;B、C项不符题意。
[考点分析]等效平衡的判断
11. 在557oC时,密闭容器中进行下列反应:CO+H2O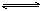 CO2+H2;若CO的起始浓度为2mol/L,水蒸气密度为3mol/L,达到平衡时测得CO2的浓度为1.2mol/L。求CO和H2O的转化率21世纪教育网
CO2+H2;若CO的起始浓度为2mol/L,水蒸气密度为3mol/L,达到平衡时测得CO2的浓度为1.2mol/L。求CO和H2O的转化率21世纪教育网
[答案与解析] CO+H2O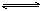 CO2+H2;
CO2+H2;
起始浓度(mol/L): 2 3 0 0
转化浓度(mol/L): 1.2 1.2 1.2 1.2
平衡浓度(mol/L): 0.8 1.8 1.2 1.2
所以CO的转化率=1.2/2×100%=60%
H2O(g)的转化率=1.2/3×100%=40%
[考点分析]利用平衡常数和平衡移动原理判断转化率大小变化;运用化学平衡移动原理判断转化率的变化题型是很重要的一种题型,化学平衡移动通常带来转化率的变化,温度不变则平衡常数不变。解题时要注意分析导致平衡移动的因素是什么,将反应过程和反应结果分开判断。
10. 在密闭容器中进行的如下反应:2SO2(g)+O2(g)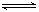 2SO3(g)。SO2的起始浓度是0.4mol/l, O2的起始浓度是1mol/l,当SO2的转化率为80%时,反应达到平衡状态.
2SO3(g)。SO2的起始浓度是0.4mol/l, O2的起始浓度是1mol/l,当SO2的转化率为80%时,反应达到平衡状态.
(1)求反应的平衡常数
(2)若将平衡时反应混合物的压强增大1倍,平衡将如何移动?
(3)若将平衡时反应混合物的压强减少1倍,平衡将如何移动?
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡又将如何移动?
[答案与解析]
2SO2(g)+O2(g)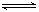 2SO3(g)
2SO3(g)
2 1 2
起始时(mol/l) 0.4 1 0
转化了(mol/l) 0.4×80% 1/2×0.4×80% 0.32
平衡时(mol/l) 0.08 0.84 0.32
平衡常数K=0.322/(0.84 ×0.082)= 400/21;压强增大1倍,各组分的浓度增大1倍;
Qc=0.642/(1.68 ×0.162)=200/21<400/21.即Qc<K,所以平衡向正方向移动.同理压强减少1倍,各组分的浓度减少1倍,经过计算Qc>K,所以平衡向逆方向移动. 向平衡混合气体中充入稀有气体Ar,总压增大,但反应混合物中的各组分的浓度不发生改变,所以平衡不发生移动。
[考点分析]利用平衡常数解释压强改变对化学平衡的影响
9. A 、B、 C、D为四种易溶物质,它们在稀溶液中建立如下平衡:A+2B+H2O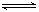 C+D。当加水稀释时,平衡向 (填“正”或“逆”)反应方向移动,理由是
C+D。当加水稀释时,平衡向 (填“正”或“逆”)反应方向移动,理由是
[答案与解析]该化学平衡常数Kc=[C]·[D]/[A]·[B]2,加水稀释后,A 、B、 C、D四种物质稀释相同的倍数,但Qc=c(C)·c(D)/c(A)·c(B)2>Kc,所以加水稀释后,平衡向逆方向移动。
[考点分析]利用平衡常数解释浓度改变对化学平衡的影响
8. 近年来,某些自来水厂用液氯进行消毒处理时还加入少量液氨,NH3+HClO H2O+NH2Cl(一氯氨)。NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌消毒时间的原因?!
H2O+NH2Cl(一氯氨)。NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌消毒时间的原因?!
[分析与解答]NH3+HClO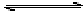 H2O+NH2Cl,当氯气(或说HClO)消耗时,平衡左移生成HClO,由于NH2Cl比HClO稳定,故试剂 保存时间长。
H2O+NH2Cl,当氯气(或说HClO)消耗时,平衡左移生成HClO,由于NH2Cl比HClO稳定,故试剂 保存时间长。
[解析]综上所述,电解质电离、溶解结晶、气体气化液化、盐类水解等过程是平衡移动过程,可以运用平衡移动原理对其变化过程中现象加以解释。
[考点分析]平衡移动原理的应用
7. 反应 2X(气)+ Y(气) 2Z(气)+热量,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n2)与反应时间(t)的关系如右图所示。下述判正确的是
2Z(气)+热量,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n2)与反应时间(t)的关系如右图所示。下述判正确的是
A.T1>T2,p1<p2 B.T1<T2,P1>p2
C.T1>T2,P1>p2 D.T1<T2,p1<p2
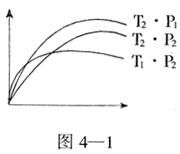 [答案]C
[答案]C
[解析]首先分析反应:这是一个气体的总物质的量减小(体积减小)、放热的可逆反应,低温、高压对反应有利,达平衡时产物Z的物质的量n2大,平衡点高,即图示曲线T2、p1。再对比图示曲线T2、p2,温度相同,压强不同,平衡时n2不同(pl时的n2>P2时的n2),由此分析p1>p2,再从反应速率验证,T2、P1的曲线达平衡前斜率大(曲线陡)先到达平衡,也说明压强是 p1>p2(增大反应压强可以增大反应速率)。然后比较曲线T2、p2与T1、p2,此时压强相同,温度不同,温度低的达平衡时n2大,平衡点高(曲线T2、p2),由此判断温度T1>T2;再由这两条曲线达平衡前的斜率比较,也是T1、p2的斜率大于T2、p2,T1、p2先到达平衡,反应速率大,也证明T1>T2。由此分析得出正确的判断是T1>T2,p1>p2,选项C的结论正确21世纪教育网
[考点分析]平衡移动原理在平衡图像题中的应用
6. 某化学反应2A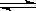 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
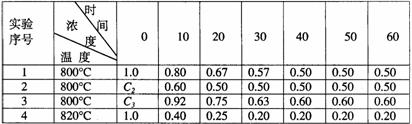
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
[答案](1)实验1中,反应在10min到20min内的平均反应速率为(0.80 - 0.67)mol·L-1÷10min = 0.013mol·L-1·min-1。
(2)实验1与实验2相比,平衡时的组成保持不变,温度保持不变,所以起始时A的浓度与实验1相同,即1.0mol·L-1,由于实验2的反应速率大于实验1,所以实验2中隐含的反应条件是使用了催化剂。
(3)实验3中,平衡时A 的浓度大于实验1,所以C3应大于1.0 mol/L,在其他条件不变时V3﹥V1
(4)升高温度(从800℃变成820℃)平衡时,A的浓度下降,表明平衡向正反应方向移动,因此正反应为吸热反应。
[解析]本题是利用不同时间或不同条件下A的浓度变化值考查化学平衡移动原理,题目设计新颖,尤其是第2问更具特色,利用图象、表格考查化学基础知识是上海试题的特色,也代表当前命题方向和趋势。
[考点分析]化学反应速率的探究
5. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是
A.反应开始到10s,用Z表示的平均反应速率为0.158 mol/(L•s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)  Z(g)
Z(g)
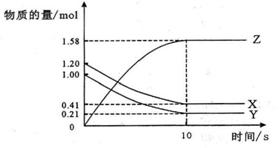
[答案]C
[解析]由图可知,反应至10s时达到平衡,Z由0mol增加到1.58mol,X由1.2mol减少到0.41mol,Y由1.00mol减少到0.21mol,所以Y的转换率为1.00-0.21/1.00×100%=79%;X的物质的量浓度减少了1.20-0.41/2=0.79/2mol/L到10S用Z表示的反应速率为1.58-0/2×10=0.079mol/L.S;X、Y、Z物质的量变化之比为0.79:0.79:1.58=1:1:2,所以化学方程式应为X(g)+Y(g)
 2Z(g)
2Z(g)
[考点分析]化学反应速率图像的分析
4. 对于可逆反应4 NH3(g)+5O2(g) 4NO(g)+6 H2O(g)下列叙述正确的是( )
4NO(g)+6 H2O(g)下列叙述正确的是( )
A.达到化学平稳时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平稳状态
C.达到化学平稳时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
[答案]A
[解析]同一反应速率用不同物质的浓度变化表示时,速率之比等于计量系数之比。A中v 正(O2)/v逆(NO)=5/4 ,A正确。同理D中v 正(NH3)/v逆(H2O)=4/6=2/3,即3v 正(NH3)=2v逆(H2O)。选项B只表示出了正反应的速率,不是平衡状态,选项C增加容积,即减小压强会使正、逆反应的速率都减小,C选项错误.
[考点分析]影响化学反应速率的因素
3. 在一定条件下,反应N2+3H2
 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A. V (H2)=0.03mol/(L·min) B. VN2)=0.02mol/(L·min)
C. V (NH3)=0.17g/(L·min) D. V (NH3)=0.01mol/(L·min)
[答案]D
[解析]根据题目可知V(NH3)=0.01mol/(L·min),根据反应系数与化学反应速率的关系可求出V(H2)=0.015mol/(L·min)
[考点分析]有关化学反应速率的简单计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com