
5. 对已达化学平衡的下列反应 2X(g)+Y(g)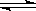 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
[答案]C
4. 可逆反应∶2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是:
2NO+O2在密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n molO2的同时生成2n molNO2 ②单位时间内生成n molO2 的同时,生成2n molNO ③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
[答案]A
3. 在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:
A(固)+2B(气)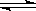 C(气)+D(气)已达平衡的是
C(气)+D(气)已达平衡的是
A.B的物质的量浓度 B.混合气体的密度
C.混合气体的平均相对分子质量 D.混合气体的压强
[答案]D
2. 在一定温度下,可逆反应X(g)+3Y(g)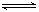 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
A. Z生成的速率与Z分解的速率相等
B. 单位时间生成a mol X,同时生成3a mol Y
C. X、Y、Z的浓度不再变化
D. X、Y、Z的分子数比为1∶3∶2
[答案]AC
1. 可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A.3υ正(N2)=υ正(H2) B.υ正(N2)=υ逆(NH3)
C.2υ正(H2)=3υ逆(NH3) D.υ正(N2)=3υ逆(H2)
[答案]C
17. 如图,条件一定时,反应2NO(g)+O2(g) 2NO2(g) △H<0中NO的百分含量NO%与T变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是
( )
2NO2(g) △H<0中NO的百分含量NO%与T变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是
( )
A. a B. b
 C. c D.
d
C. c D.
d
[答案]D
[解析] a、b在曲线上为平衡点,c、d点未达平衡。d点在曲线右上方,从d点向横坐标引辅助线,可知该温度平衡时NO%比d点的小,说明该点未达平衡,且V正<V逆平衡向逆向移动,或从d点向纵坐标引垂线,d点T比平衡点的高,该反应正向放热,升高温度平衡向吸热的逆向移动,同样得出结论V正<V
[考点分析]利用平衡图像判断平衡状态
[专题突破]
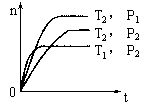
16. 反应2X(g)+Y(g)  2Z(g) △H,在不同温度(T1和T2)及压强(P1和P2)下,产物Z 的物质的量n(Z)与反应时间t的关系如图所示,下述判断正确的是( )
2Z(g) △H,在不同温度(T1和T2)及压强(P1和P2)下,产物Z 的物质的量n(Z)与反应时间t的关系如图所示,下述判断正确的是( )
 A.T1<T2,P1<P2
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
[答案]C
[解析]T相同时(上面2条曲线),p越大反应速率v越快,达到化学平衡的时间t越短,故P1>P2 ;若从纵坐标n(Z)来分析,P2→P1,n(Z)增大,平衡向正向移动,对照反应特征(气体体积减小)可知P1>P2 。同理,压强相同时(下面2条曲线),温度越高反应速率越快,达到化学平衡的时间越短,故T1>T2 ,或从n(Z)来分析,T2→T1,n(Z)减小,平衡向逆向移动(正向放热则逆向吸热),说明P2→P1,n(Z),
[考点分析]利用平衡图像判断外界条件对平衡移动的影响
15.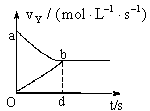 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)
在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度V正、V逆与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)( )
2Z(g),并达平衡,以Y的浓度改变表示的反应速度V正、V逆与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)( )
A.2-Saob B.1-Saob
C.2-Sabdo D.1-Sbod
[答案]B
[解析] 根据v-t曲线计算反应物的平衡浓度,初看题目似乎无从下手,若静心思考,从定义出发,Y减少的浓度△C(Y)=vt,随着反应进行,逆反应同时生成部分Y,因此Y的平衡浓度为初始浓度与消耗浓度之差。瞬时速率与时间的乘积即为微小矩形的面积,累积计算则Y减少的浓度表示为Saobd,Y增加的浓度表示为Sobd,则Y的平衡浓度表示为:1-(Saobd-Sobd)=1-Saob,
[考点分析]利用v-t图像进行平衡的相关计算
14. 在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是( )
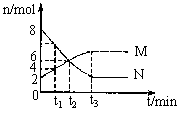 A. 反应的化学方程式为2M
A. 反应的化学方程式为2M N
N
B. t2时V正=V逆,达到平衡
C. t3时V正 > V逆
D. t1时浓度C(N)=2C(M)
[答案]C
[解析]解题关键是抓住起点和t1、t2、t3等特殊点,在0到t2时间内(或选取0到t3之间的任一点)n(N)从8mol到4mol减少了4mol,n(M)从2mol到4mol增大了2mol,因此N为反应物,方程式为2N M(从反应趋势看,N没有完全转化为M,故为可逆反应)。t2时n(N)=n(M),瞬时浓度也相等,但浓度变化
M(从反应趋势看,N没有完全转化为M,故为可逆反应)。t2时n(N)=n(M),瞬时浓度也相等,但浓度变化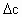 并不相等,实际是V正 > V逆,t3时n(M)、n(N)不再改变,达到了平衡状态,V正=V逆,t1时n(N)=2n(M),体积相同,c与n成正比
并不相等,实际是V正 > V逆,t3时n(M)、n(N)不再改变,达到了平衡状态,V正=V逆,t1时n(N)=2n(M),体积相同,c与n成正比
[考点分析]利用平衡图像描述可逆反应达到平衡的过程
13. 某温度下在密闭容器中发生如下反应:2M(g)+N(g) 2E(g), 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N的混合气体达平衡时M的转化率为( )
2E(g), 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N的混合气体达平衡时M的转化率为( )
A.20% B.40% C.60% D.80%
[答案]C21世纪教育网
[解析]按照“一边归零”的方法知:两种起始状态“2mol E” 与“2mol M和1mol N ”是等温等压下的等效平衡关系。根据题意可得:

2/(2+x)=1/1.2 解得:x=0.4,故只充入2mol M和1mol N的混合气体达平衡时M的转化率为(2-0.4×2)/2=0.6。
[考点分析]等效平衡的灵活应用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com