
3. 用惰性电极电解硫酸铜溶液,当加入0.1mol Cu(OH)2使溶液恢复原来的浓度和pH时,电极上转移电子的物质的量是 ( )
A.0.1mol B.0.2mol
C.0.3mol D.0.4mol
2.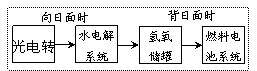 下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
例15.(09广东化学14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH
溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4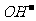
B.以NaOH溶液为电解液时,负极反应为:Al+3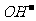 -3e-=Al(OH)3↓
-3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
[解析]电解质溶液显碱性或中性, 该燃料电极的正极发生反应为:O2+2H2O+4e-=4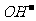 ,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4
,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4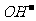 -3e=
-3e=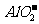 + 2H2O,B错; 该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4
+ 2H2O,B错; 该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4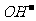 = 4
= 4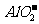 + 2H2O溶液PH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错高
+ 2H2O溶液PH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错高
[答案]A
例16.(09年浙江卷)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li 的高分子材料。这种锂离子电池的电池反应为: Li+2Li
的高分子材料。这种锂离子电池的电池反应为: Li+2Li
下列说法不正确的是
A.放电时,负极的电极反应式:Li-e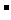 =Li
=Li
B.充电时,Li 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li 向负极移动
向负极移动
[解析]A项,Li从零价升至正价,失去电子,作为负极,正确;B项,反应逆向进行时。反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应,正确;C项,由于Li可以与水反应,故应为非水材料,正确;D项,原电池中阳离子应迁移至正极失电子,故错。
[答案]D
例17.(09年山东卷)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
[解析](1) 负极上是失电子的一极 Zn失电子有负极经外电路流向正极。(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+ 置换为单质而除去。(3)阴极上得电子,发生还原反应, H+得电子生成氢气。因为MnSO4-MnO2-2 e-,通过2mol电子产生1molMnO2,质量为87g。
[答案]
(1)Zn(或锌) 正极 (2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀
b (3)2H++2e-→H2 ,87g
[专题突破]
1.(长春市实验中学2009届高三理科综合)钢铁在潮湿的空气中会被腐蚀,发生的原电池反应:2Fe+2H2O+O2  2Fe2++4OH-。以下说法正确的是
( )
2Fe2++4OH-。以下说法正确的是
( )
A.负极发生的反应为:Fe-2e- Fe2+
Fe2+
B.正极发生的反应为:2H2O+O2+2e- 4OH-
4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
例13. 将两个铂电极插入500mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
A.4×10-3mol/L B.2×10-3mol/L C.1×10-3mol/L D.1×10-7mol/L
[解析]根据电解规律可知阴极反应:Cu2++2e-=Cu,增重0.064gCu,应是Cu的质量,根据总反应方程式:
2CuSO4+2H2O 2Cu+O2↑+2H2SO4--->4H+
2Cu+O2↑+2H2SO4--->4H+
2×64g 4mol
0.064g x
x=0.002mol
[H+]=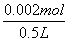 =4×10-3mol/L
=4×10-3mol/L
[答案]A
例14.(2009届福建省泉州市俊来中学高三年级月考化学)电解100mL含c(H+)=0.30mol/L
的下列溶液。当电路中通过0.04mol电子时,理论上析出金属质量最大的是
A.0.10mol/L Ag+ B.0.20mol/L Zn2+ C.0.20mol/L Cu2+ D.0.20mol/L Pb2+
[解析]电解时阴极上溶液中离子的反应顺序为Ag+ >Cu2+ >H+ >Pb2+ >Zn2+ ,
A项中Ag+ 先反应,H+后反应,可得到Ag:0.10mol/L×0.1L×108g/mol=1.08g ;H2 :0.03g 。
B项中H+先反应,Zn2+后反应,可得H2:0.03g ;Zn:(0.04mol-0.03mol)÷2×65g/mol=0.325g 。
C项中Cu2+先反应,H+后反应,可得到Cu:0.02mol/L×0.1L×64g/mol=1.28g 。D项中H+先反应,Pb 2+后反应,可得到H2:0.03g ;Pb:(0.04mol-0.03mol)÷2×207g/mol=1.05g 。
因此理论上析出金属质量最大的是C。
[答案]C
例11.银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为________;正极发生的反应为_________;反应过程中产生有臭鸡蛋气味的气体,则原电池总反应方程式为___________________________。
[解析]要善于抓住题示信息,“黑色褪去而银不会损失”,必然发生变化:Ag2S Ag,
Ag,
显然这是原电池的正极反应,Ag2S+2e-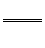 2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-
2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-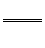 Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O
Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O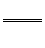 2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O
2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O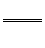 6Ag+2Al(OH)3↓+3H2S↑。
6Ag+2Al(OH)3↓+3H2S↑。
[答案]Al-3e-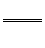 Al3+ Ag2S+2e-
Al3+ Ag2S+2e-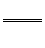 2Ag+S2-
2Ag+S2-
3Ag2S+2Al+6H2O 6Ag+2Al(OH)3↓+3H2S↑
6Ag+2Al(OH)3↓+3H2S↑
例12.钢铁在很弱的酸性或中性条件下发生电化学腐蚀时,正极的反应式为 ( )
A.Fe-2e- Fe2+
B.2H++2e-
Fe2+
B.2H++2e- H2↑
H2↑
C.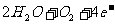
 4
4 D.Fe-3e-
D.Fe-3e- Fe3+
Fe3+
[解析]钢铁中含有多种杂质,在考虑钢铁的电化学腐蚀时,为了简化问题,主要讨论碳杂质问题。也就是以Fe为负极,C为正极的原电池反应。在中性条件或弱酸性条件下发生的是吸氧腐蚀。原电池的正极为C,发生的是还原反应,即得电子反应,故A、D选项应排除。在B、C选项中,B项是析氢腐蚀的电极反应式
[答案]C
例7.下列关于金属腐蚀的叙述正确的是 ( )
A.金属在潮湿情况下的腐蚀实质是M+nH2O====M(OH)n+ H2↑
H2↑
B.金属的化学腐蚀实质是M-ne- Mn+,电子直接转移给氧化剂
Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
[解析]A项金属在潮湿情况下有可能进行析氢腐蚀,也有可能进行吸氧腐蚀,题目只给出了析氢腐蚀实质。C项中,金属铝的化学腐蚀可以在碱性条件下进行,故此选项错。
[答案]BD
例8.(09年广东卷)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A. 锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
[解析]锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;潮湿的环境将会加快金属的腐蚀速率,C正确;电化学腐蚀过程实质是有电子的转移,属于化学反应过程,D错。
[答案]BC
例10.(09广东理科基础25)钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
[解析]①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,A项正确。①中H2O的H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,故D项错
[答案]A
例5. 如图所示,a、b、c、d均为石墨电极,通电进行电解。
|

A.乙烧杯中d的电极反应为 2Cl––2e– Cl2↑
Cl2↑
B.a、c两极产生气体的物质的量相等
C.甲、乙两烧杯中溶液的pH均保持不变
|
 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
[解析]由图可以看出a、c均为阳极,分别生成O2、Cl2,所以生成的物质的量不相等;b、d均为阴极,所以d极发生的电极反应式为2H++2e-=H2↑;甲、乙两烧杯电解时的pH分别减小、增大。
[答案] D
例6. (09年安徽卷)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O 。下列说法正确的是
。下列说法正确的是
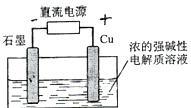 A.石墨电极上产生氢气
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
[解析]由电解总反应可知,Cu参加了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;石墨作阴极,阴极上是溶液中的H+反应,电极反应为:2H++2e-=H2↑,A选项正确;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2OH--2e-=Cu2O+H2O,当有0.1mol电子转移时,有0.05molCu2O生成,D选项错误。
[答案]A.
例3、电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是: Zn + 2 OH- -2e=ZnO + H2O Ag2O +H2O + 2e=2Ag +2 OH-
下列判断正确的是
A.锌为正极,Ag2O为负极。
B.锌为负极,Ag2O为正极。
C.原电池工作时,负极区溶液PH减小。
D.原电池工作时,负极区溶液PH增大。
解析:本题考查原电池和PH的概念。原电池中失去电子的极为负极,所以锌为负极,Ag2O为正极。B是正确答案。因为 Zn + 2 OH- -2e=ZnO + H2O ,负极区域溶液中[OH-] 不断减少,故PH减小,所以C也正确。故选B、C。
答案:BC
 例4.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
例4.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
 2LIH Ⅱ.LiH+H2O==LiOH+H2↑
2LIH Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
[解析]本题考查电化学知识。(1)原电池的实质为化学能转化成电能。总反应为2H2 + O2 =2H2O,其中H2从零价升至+1价,失去电子,即电子从a流向b。(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-。(3)铂粉的接触面积大,可以加快反应速率。(4)I.Li从零价升至+1价,作还原剂。II.H2O的H从+1降至H2中的零价,作氧化剂。由反应I,当吸收10molH2时,则生成20molLiH,V=m/ρ=20×7.9/0.82 ×10-3L=192.68×10-3L。V(LiH)/v(H2)= 192.68×10-3L/224L=8.71×10-4。20mol LiH可生成20mol H2,实际参加反应的H2为20×80%=1.6mol,1molH2转化成1molH2O,转移2mol电子,所以1.6molH2可转移3.2mol的电子
[答案]
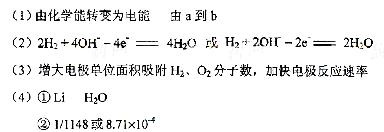
③32
例1.(09广东理科基础34)下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
[解析]锂离子电池可以充用,再次使用,属于二次电池,A项正确;铜锌原电池中铜为正极,故电流为铜流向锌,而电子是由锌流向铜,B项错;电池的实质即是化学能转化成电能,C项正确;Zn失去电子生成Zn2+,故作为负极,D项正确
[答案]B
例2.下列叙述中正确的是
A.构成原电池正极和负极的材料必须是两种金属。
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极。
C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀。
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4mol电子通过。
[解析] 两种活动性不同的金属与电解质溶液能够组成原电池,但不能因此说构成原电池电极的材料一定都是金属,例如锌和石墨电极也能跟电解质溶液组成原电池。在原电池中,活动金属中的电子流向不活动的电极,因此活动金属是负极。镀锡铁表皮破损后与电解质溶液组成原电池,铁较锡活泼,铁先失电子被腐蚀。铜锌原电池工作时,锌负极失电子,电极反应为Zn –2e==Zn2+,1molZn失去2mol电子,0.2mol锌(质量为13克)被溶解电路中有0.4mol电子通过。故选D
[答案]D
16.(安徽省白云中学09高三化学综合训练三)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com