
31.草酸晶体的化学式可表示为H2C204·xH20,为了测定x值进行下列实验:
①称取wg草酸晶体,配成100.00mL溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2S04后,用浓度为amol/L的KMnO4溶液滴定。 回答下列问题:
(1) 写出该反应的化学方程式:
(2) 实验①中,为配制准确的草酸溶液,必须定量玻璃仪器是:
(3)实验②中,滴定时,KMnO4应装在 中。
(4)若滴定用的KMn04溶液因放置而变质,浓度偏低,则根据实验求出的x值 (填“偏高” “偏低”或“无影响”)。
(5)滴定终点时,锥形瓶内溶液颜色变化是 。
(6)观察滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的草酸溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)。
(7)若滴定至终点时,共用去KMn04溶液Vml,则草酸溶液浓度
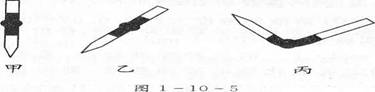
(8)排去碱式滴定管中气泡的方法应采用操作 (如图1-10--5所示)
30.已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,溶液的pH= 。
酸碱按体积比为1:10混合后溶液显中性,则a+b= 。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么
A溶液中水电离出的氢离子浓度为 mol·L-1,
B溶液中水电离出的氢离子浓度为 mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB.
29.(1)将pH=10和pH=12 的氢氧化钠溶液以 1:2的体积比混合,则混合后所得溶液的pH约为 。
(2)0.1mol/L盐酸和0.06mol/L Ba(OH)2 溶液按等体积混合后,则溶液的 pH 约为
(3)用pH=4 和pH= 11的强酸和强碱混合,使pH=10,则两溶液的体积比为 。
28. 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4 L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4 L,容器内气体对相同条件的氢气的相对密度为5。
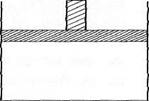
(1)反应前混合气体中V(N2):V(H2)= ;反应达平衡后V(NH3)= L;该反应中N2转化率为 。
(2)向平衡后的容器中充入O.2 mol的NH3,一段时间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了6.44 kJ的热量。
①充入NH3时,混合气体的密度将 ,在达到平衡的过程中,混合气体的密度
将 (填“增大”、“减小”或“不变”)。反应重新达平衡的混合气体对氢气的相对密度
将 5(填“>”、“<”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡
A.容器不再与外界发生热交换
B.混合气体的平均相对分子质量保持不变
C.当V(N2):、V(H2):V(NH3)=1:3:2时
D.当容器的体积不再发生变化时
③写出该反应的热化学方程式: 。
27.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH CH3COOC2H5+H20
CH3COOC2H5+H20
(1)该反应的平衡常数表达式K= 。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3 min。实验结
束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:

①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 ml.和 mol·L_1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率。浓H2S04的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 。
26.如图2l一12所示,有A、B两密闭容器,A容器中有一个移动的活塞能使容器内保持恒压,B容器能保持恒容,起始时间向容器A中充入 2 mol S02和l mol 02,向B容器中充入4 mol S02和2mol 02,并使A、B容器的容积均为l L,在保持40℃的条件下,发生反应2S02(g)+O2(g)  2S02(g),达到平衡时,A容器的体积为O.8 L。填空:
2S02(g),达到平衡时,A容器的体积为O.8 L。填空:
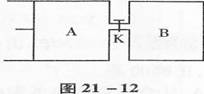 (1)A容器中S02的转化率为
;
(1)A容器中S02的转化率为
;
(2)A、B两容器中S02的转化率为A B.达平衡所需要时间A B;(填“>”、“<”或“=”)
(3)当A、B两容器连接后,打开K,一段时间后又重新达到平衡时,A容器的体积为 L:
25.图Z一2是关于N2+3H2 2NH3(正反应为放热反应)的速率一时问图像,则t1时刻使平衡发生移动的原因是( )
2NH3(正反应为放热反应)的速率一时问图像,则t1时刻使平衡发生移动的原因是( )
A.升高温度,同时增大压强
B.降低温度.同时减小压强
C.增大反应物的浓度,同时使用适宜的催化剂
D.增大反应物的浓度,同时减小生成物的浓度
24.下列仪器使用前不必检查其是否漏水的是( )
A.分液漏斗 B.碱式滴定管
 C.容量瓶 D.长颈漏斗
C.容量瓶 D.长颈漏斗
23.常温时,纯水中由水电离的c(H+)=a,pH=1的盐酸中由水电离的c(H+)=b,0.2 mol·L--1的盐酸与0.1 mol·L--1的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是 ( )
A.a>b=c B.a>c>b C.c>b>a D.b>c>a
22.人体血液的pH保持在7.35-7.45,适量的C02可以维持这个pH变化范围,可用下面化学方程式表示:H2O+C02 H2CO3
H2CO3 H++HCO3--,又知人体呼出的气体中C02的体积分数约5%,下列说法正确的是 ( )
H++HCO3--,又知人体呼出的气体中C02的体积分数约5%,下列说法正确的是 ( )
A.太快而且太深的呼吸可导致碱中毒
B.太快而且太深的呼吸可导致酸中毒
C.太浅的呼吸可导致碱中毒
D.太浅的呼吸可导致体内pH升高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com