1.原子的电子式:
原子的最外层有多少个电子就在其元素符号周围画多少个小黑点“·”或小叉“×”。如:Li×, ︰Cl·
2.离子的电子式:
①阳离子:简单的阳离子(一般指单原子形成的阳离子)是元素原子失去最外层电子后形成的,此时若原最外层没有电子,其电子式就是它的离子符号,如钠离子写成Na+、钡离子写成Ba2+;复杂的阳离子是原子团失去一个或几个电子形成的,其电子式不仅要画出各原子的最外层电子以及它们的成键关系,而且要用“[
]”将原子团括起来,并在其右上角标明所带的正电荷数,电子式中的小黑点和小叉总数为原子团中各原子最外层电子总数减去原子团所带的电荷数值。如:
[H︰N︰H]
+
②阴离子:简单阴离子,一般最外层是2个电子或8个电子的稳定结构,在元素符号周围画出最外层电子,并用“[ ]”将其括起来,并在右上角标明所带的负电荷数,其中小黑点和小叉总数为原子的最外层电子数加上所带的电荷数值的绝对值.如:[H︰]
-、[︰Cl︰]
-
 复杂的阴离子,其电子式要根据各原子的成键关系画出所有原子的最外层电子,然后用“[
]”将它们括起来,并在右上角标明所带的负电荷数,其小黑点和小叉总数为原子团中
复杂的阴离子,其电子式要根据各原子的成键关系画出所有原子的最外层电子,然后用“[
]”将它们括起来,并在右上角标明所带的负电荷数,其小黑点和小叉总数为原子团中
各原子的最外层电子数之和加上所带的电荷数值的绝对值. 如:SO42-写成 [ ]2-
3.单质分子的电子式:
根据原子的最外层电子数和分子的组成判断出成键电子数和各原子的成键关系,再画出所有原子的最外层电子。如H
2写成H:H ;Cl
2写成︰Cl︰Cl︰
4.化合物的电子式:
①共价化合物是原子间通过共价键形成的化合物,原子间的单键即为一对共用电子,若为双键则有两对共用电子,依此类推。一般来说,8减去原子的最外层电子数等于该原子的成键数目(H例外)。写电子式时,共用电子对写在两成键原子之间,未成键的最外层电子,也应在元素符号周围画出。在共价化合物中,各元素原子最外层一般都达到了8电子(或2电子)的稳定结构。 如:HCl写成 H︰Cl︰,CO
2写成 O ∷C∷
O ;至于含氧酸的电子式,一般来说先由酸的元数确定其结构中所含-OH的数目(一元酸有一个-OH,n元酸有n个-OH),然后再根据含氧酸的分子组成来确定其结构式或电子式。如:HClO写成H︰O︰ Cl︰
②离子化合物由阴、阳离子的电子式组成,但相同的离子不能合并,若有多个阳离子或多个阴离子,书写时要使每一个离子都与带相反电荷的离子直接相邻,并注意对称、规范。如:NaCl写成Na
+[︰Cl︰]
-;MgCl
2写成[︰Cl︰]
-Mg
2+
[︰Cl︰]
-;
5.游离基的电子式:
游离基是由分子失去一个或多个原子所形成的活性基团,它显电中性,电子式中的小黑点和小叉总数为各原子的最外层电子数之和。如:-OH写成·O︰H
6.用电子式表示化合物的形成过程:
共价化合物:如H
2S的形成,H·+·S·+·H → H︰S︰H
离子化合物:如CaCl
2的形成,︰Cl·+ ·Ca· +·Cl︰→[︰Cl︰]
-Ca
2+[︰Cl︰]
-
考点三 表示物质变化的化学用语

 复杂的阴离子,其电子式要根据各原子的成键关系画出所有原子的最外层电子,然后用“[
]”将它们括起来,并在右上角标明所带的负电荷数,其小黑点和小叉总数为原子团中
复杂的阴离子,其电子式要根据各原子的成键关系画出所有原子的最外层电子,然后用“[
]”将它们括起来,并在右上角标明所带的负电荷数,其小黑点和小叉总数为原子团中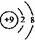 B.CO2的分子模型示意图:
B.CO2的分子模型示意图:
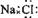 D.N2的结构式::N≡N:
D.N2的结构式::N≡N: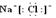 ,N2的结构式为N≡N,故B、C、D均不正确。
,N2的结构式为N≡N,故B、C、D均不正确。