
4.(2008·上海)下列关于化学学习和研究的说法错误的是( )
A.化学模型有助于解释一些化学现象 B.质量守恒定律是大量实验事实的总结
C.化学家提出的假设都能被实验证明 D.化学基本原理的应用是有一定条件的
[解析]如果化学家提出的假设是错误的,那肯定是不能通过实验来证明的。
[答案]C
3.(2007·肇庆)下列各组中的关系正确的是( )
A.同位素:O2和O3 B.同分异构体:氨基乙酸和硝基乙烷
C.同素异形体:K2O、K2O2、KO2 D.同系物:分子式相差CnH2n+2的有机物
[解析]同位素是针对原子而言的,同素异形体才针对的是单质,故A C不正确;D中分子式相差CnH2n+2的有机物不一定是同系物,因为有机物会有同分异构体。
[答案]B
2.(09年广东理基·28)下列说法正确的是
A.MgSO4晶体中只存在离子键
B.含Ca2+、Mg2+的水都是硬水
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.玻璃是氧化物,成分可表示为Na2O·CaO·6SiO2
答案:C
解析:MgSO4晶体中除存在离子键外,还在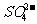 离子中存在共价键,故A选项错误。硬水是指含有Ca2+、Mg2+较多的水,因此B选项错误。雾是是一种胶体,属于气溶胶,因此在阳光下可观察到丁达尔效应,C选项正确。玻璃是一种硅酸盐制品,虽然可以用氧化物的形式表示为Na2O·CaO·6SiO2,但是并不说明就是氧化物,故D选项错误。
离子中存在共价键,故A选项错误。硬水是指含有Ca2+、Mg2+较多的水,因此B选项错误。雾是是一种胶体,属于气溶胶,因此在阳光下可观察到丁达尔效应,C选项正确。玻璃是一种硅酸盐制品,虽然可以用氧化物的形式表示为Na2O·CaO·6SiO2,但是并不说明就是氧化物,故D选项错误。
1.(09年广东理基·19)下列化学用语使用不正确的是
A.Na+的结构示意图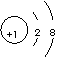

B.纯碱的化学式为Na2CO3
C.聚乙烯的结构简式为CH2=CH2
D.高氯酸(HCIO4)中氯元素的化合价为+7
答案:C
解析:聚乙烯的结构简式应为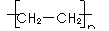
 ,CH2=CH2表示的聚乙烯的单体乙烯的结构简式,
,CH2=CH2表示的聚乙烯的单体乙烯的结构简式,
2.5g×80% x 解得:x = 2.4 g
(5)设0.335g纯 Na2C2O4与KMnO4恰好反应完全,需纯KMnO4为y,则有:
2KMnO4 + 8H2SO4 + 5Na2C2O4==K2SO4+ 5Na2SO4+ 2MnSO4+ 10CO2↑+ 8H2O
2×158 5×134
y 0.335g 解得:y =0.158 g
故该KMnO4的纯度为:0.158g/0.165g×100% = 95.8%
[答案](1)3MnO2 + KClO3 + 6KOH == 3K2MnO4 + KCl+ 3H2O
(2)3MnO42-+ 4H+ == MnO2 + 2MnO4- +2H2O
(3)2.4 g
(4)2KMnO4 + 5Na2C2O4 + 8H2SO4==K2SO4+ 5Na2SO4+ 2MnSO4+ 10CO2↑+ 8H2O
(5)95.8%
★抢分频道
限时基础训练
2.三大守恒定律(质量守恒,得失电子守恒和电荷守恒)是书写化学方程式和离子方程式的依据。灵活运用这三大定律,有利于方程式的快速配平和正确书写。如:氧化还原反应方程式的配平,往往需要利用得失电子守恒来确定氧化剂和还原剂的比例;离子方程式的配平离不开电荷守恒定律。当然,让守恒思想充分渗透到解题中,还能让许多看似很复杂的计算题变得迎刃而解。
新题导练3
3-1.(2006·重庆)能正确表示下列反应的化学方程式是( )
A.黄铁矿煅炼:2FeS2+5O2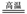 FeO+4SO2
FeO+4SO2
B.石英与石灰石共熔:SiO2+CaO CaSiO3
CaSiO3
C.氨的催化氧化:4NH3+5O2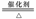 4NO+6H2O
4NO+6H2O
D.氯气与石灰乳反应:2Cl2+2Ca(OH) 2=CaCl2+CaClO2+2H2O
[解析]A中产物应为Fe2O3;B中石灰石的化学式为CaCO3;D中产物为Ca(ClO)2。
[答案]C
3-2. (2008·全国理综)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转化为MnO2和KMnO4,滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是 ;
(2)K2MnO4制备KMnO4的离子方程式是 ;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+ 和CO2,该反应的化学方程式是
。
(5)上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。
[解析]根据题意可逐步写出(1)(2)(4)的方程式,要注意根据需要添加试剂水。(3)设生成KMnO4的理论产量为x,由(1)(2)方程式可知,
3MnO2 - 2KMnO4
3×87 2×158
1.化学方程式、离子方程式、电极反应式和热化学方程式分别从不同的侧重点反应出化学反应过程中的物质变化和能量变化。化学方程式表示出在一定条件下反应物与生成物之间量的关系;离子方程式侧重离子反应的实质;电子反应式电子的得失与流向;热化学方程式为表示出化学反应中的能量变化,在化学方程式的基础上附加了物质的状态(反应热与物质状态有关)。
6.用电子式表示化合物的形成过程。如HCl的形成过程:
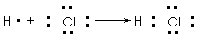
[例3] (2008·山东)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: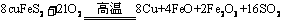 ;若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
;若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2 :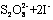
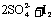
通过改变反应途径Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。____ ____、
______ _____(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是_________ _____。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为_____________。
证明炉渣中含有FeO的实验现象为______ _____。
[解析](1)由氧化还原反应概念易知,反应中Cu、O的化合价降低,被还原。(2)从能够吸收SO2和变废为宝的角度出发可用b、c来回收。(3)Fe3+有氧化性,可氧化I-,而改变反应途径;Fe2+有还原性,可被K2S2O8氧化而改变反应途径。(4)Al(OH)3能溶于NaOH溶液,而Fe(OH)3不溶,可加入过量的NaOH溶液除去Al(OH)3 ;利用Fe2+的还原性,能使酸性KMnO4溶液褪色,可用稀硫酸、KMnO4溶液来验证炉渣中含有FeO。
[答案](1)Cu、O (2)b、c
(3)2Fe3++2I- 2Fe2++I2 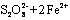
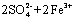
(4)a.Al3+ + 4OH- == AlO2- + 2H2O
b.稀硫酸、KMnO4溶液 ;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
★ 高考重点热点题型探究
热点1 原子结构示意图、电子式、结构式、结构简式
[真题1](2006·广东)SO42-和S2O82-的结构中,硫原子均位于由氧原子组成的正四面体的中心,且所有原子最外层都满足8个电子结构。下列说法正确的是( )
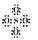 A.S2O82-没有非极性键
B.SO42-的电子式为:
A.S2O82-没有非极性键
B.SO42-的电子式为:
C.S2O82-比SO42-稳定 D.S2O82-有强氧化性
[解题思路]根据题意,由题给信息“硫原子均位于由氧原子组成的正四面体的中心,且所有原子最外层都满足8个电子结构”,给合SO42-的结构、S2O82-中S的化合价来确定S2O82-的结构而求解。
 [解析]由题意知,A中O-O为非极性键;B中
[解析]由题意知,A中O-O为非极性键;B中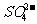 的电子式为[ ]2-;C中的S2O82-有强氧化性,没有SO42-稳定。
的电子式为[ ]2-;C中的S2O82-有强氧化性,没有SO42-稳定。
[答案]D
名师指引
共价键可分为极性共价键和非极性共价键。存在于同种元素原子之间,共用电子对无偏向和偏离的共价键为极性共价键。极性共价键不参与形成化合价,这就是单质的化合价为0,H2O2、Na2O2中的O的化合价为-1的原因。
新题导练1
1-1.(2006·江苏)以下有关氢化物的叙述正确的是( )
A.一个D2O分子所含的中子数为8 B.热稳定性:H2S>HF
C.HCl的电子式为 D.NH3的结构式为:
D.NH3的结构式为: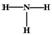
[解析] A中D2O分子所含的中子数为10;B中热稳定性顺序为:HF>H2S ;C中HCl为共价化合物,没有阴、阳离子,电子式错误。
[答案]D
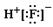 1-2.(2008·深圳实验中学)下列图式正确的是( )
1-2.(2008·深圳实验中学)下列图式正确的是( )
 A.氟化氢的电子式:
B.次氯酸的结构式:H-Cl-O
A.氟化氢的电子式:
B.次氯酸的结构式:H-Cl-O
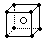
C.铝离子的结构示意图: D.氯化铯的晶体结构(晶胞)模型:
[解析]A中HF为共价化合物,无离子;B中次氯酸的结构式为:H-O-Cl;C中铝离子结构示意图的原子核外只有两个电子层,原来的最外层电子已失去。
[答案]D
热点2 化合价、质量守恒定律
[真题2](2008·重庆)硝化甘油(C3H5N3O9)可用于治疗心绞痛,因为它在人体内被缓慢氧化生成A气体:C3H5N3O9+5O2 == 12A+12CO2+10H2O,则A的化学式为( )
A.NO B.NO2 C.N2 D.N2O
[解题思路]利用质量守恒定律,根据元素守恒来解答即可。
[解析]根据质量守恒定律,“反应前后元素的种类和各原子的个数不变”易知,12mol产物A中含有N原子12mol,O原子12mol,故A为NO。
[答案]A
名师指引
“反应前后元素的种类和各原子的个数不变”是质量守恒定律的内在涵义。质量守恒定律的应用非常广泛,元素守恒是质量守恒定律的应用之一。如:
有一在空气中暴露过的KOH固体,经分析知其中含水7.62%,K2CO3 2.88%,KOH 90%,若将此样品1克加入到46.00mL的1mol/L盐酸中,过量的酸再用1.07mol/L KOH溶液中和,蒸发中和后的溶液可得固体多少克?
[解析]根据题意,经过两次反应,蒸发中和后的溶液得到的固体为KCl,且KCl中的Cl原子全部来自于46.00mL的1mol/L盐酸。故由Cl元素守恒可得KCl的质量为:
mKCl = 46.00mL×10-3×1mol/L×74.5g/mol = 3.427g
新题导练2
2-1.(2007·广州二中)某些化学试剂可用于净水。水处理中使用一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm. yH2O]x,式中m等于( )
A.3-n B.6-n C.6+n D.3+n
[解析] Al的化合价为+3,OH-的化合价为-1,Cl也为-1价,H2O可作为一个整体,其化合价可看成为0,然后依据化合物中各元素化合价代数和为零的原则,列出方程式:
2×(+3)+ n×(-1)+ m×(-1)+ y×0=0,解得:m=6-n
[答案]B
2-2.(2008·北京东城)有一未完成的离子方程式:□□+XO3-+6H+ == 3X2+3H2O,据此判断:X元素的最高化合价为( )
A.+7 B.+5 C.+4 D.+1
[解析]根据元素守恒和电荷守恒可知所缺物质为X-,且其系数为5,即X元素的最低化合价为-1价,所以其最高正价为+7价。
[答案]A
热点3 化学方程式、离子方程式的书写
[真题3](2008·上海)下列化学用语表示正确的是( )
A.硫酸氢钾加热熔融的电离方程式:KHSO4 = K+ + H+ + SO42-
 B.碳酸氢钠和盐酸反应的离子方程式:
B.碳酸氢钠和盐酸反应的离子方程式: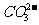 + 2H+ CO2↑+
H2O
+ 2H+ CO2↑+
H2O
|
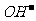
D.工业冶炼铝的化学方程式:2AlCl3 === 2Al + 3Cl2↑
[解题思路]熟练掌握化学方程式、离子方程式、电离方程式、电极反应式的书写,特别是一些特殊反应式的书写。
|
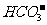 +2H+ == CO2↑+ H2O;工业冶炼铝的化学方程式为:2Al2O3 ==== 4Al+3O2↑
+2H+ == CO2↑+ H2O;工业冶炼铝的化学方程式为:2Al2O3 ==== 4Al+3O2↑
[答案]C
名师指引
5.电极反应式:表示电极上发生氧化反应或还原反应的式子。要能正确书写原电池的正、负极反应式,总反应式;电解池的阴、阳极反应式,总反应式。详见第36讲。
4.热化学方程式:表明反应放出或吸收热量的化学方程式。书写热化学方程式应注意:
(1)需标明反应物、生成物的聚集状态。
(2)反应系数只表示物质的量,不再表示分子个数,所以可以用分数或倍数。
(3)⊿H表示反应热的数值,无需注明+或-号,但要有单位,且要与反应系数成比例。
(4)需注明测定的温度和压强,若不注明则指的是温度为25℃,压强为101kPa
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com