
2.表示符号:Vm
1.定义:单位物质的量的气体所占的体积,叫做气体摩尔体积。
3.关系式:n =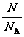 ;n =
;n =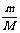
[例1]下列关于物质的量的叙述中,正确的是( )
A.1mol食盐含有6.02×1023个分子 B.Mg的摩尔质量为24
C.1mol水中含有2mol氢和1mol氧 D.1molNe含有6.02×1024个电子
[解析] NaCl为离子化合物,其结构中无分子,且食盐为宏观物质,不可用mol来描述,故A不正确;Mg的摩尔质量为24g/mol,单位不对,故B不正确;C中对1mol水的组成的描述不正确,应为:1mol水中含有2mol氢原子和1mol氧原子;故答案为D。
[答案]D
|
特别提醒: 1.摩尔只能描述原子、分子、离子、质子、中子和电子等肉眼看不到、无法直接称量的化学微粒,不能描述宏观物质。如1mol麦粒、1mol电荷、1mol元素的描述都是错误的。 2.使用摩尔作单位时,应该用化学式(符号)指明粒子的种类。 如1mol水(不正确)和1molH2O(正确);1mol食盐(不正确)和1molNaCl(正确) 3.语言过于绝对。如6.02×1023mol-1就是阿伏加德罗常数;摩尔质量等于相对原子质量、相对分子质量;1摩尔任何物质均含有阿伏加德罗常数个粒子等。 |
考点二 气体摩尔体积
2.摩尔质量(M)
1摩尔物质的质量,就是该物质的摩尔质量,单位是g/mol 。1mol任何物质均含有阿伏加德罗常数个粒子,但由于不同粒子的质量不同,因此,1 mol不同物质的质量也不同;12C的相对原子质量为12,而12 g 12C所含的碳原子为阿伏加德罗常数,即1 mol 12C的质量为12g。同理可推出1 mol其他物质的质量。
1.物质的量
(1)物质的量是七个基本物理量之一,其意义是表示含有一定量数目的粒子的集体。符号为:n ,单位为:摩尔(mol)。
(2)物质的量的基准(NA):以0.012kg12C所含的碳原子数即阿伏加德罗常数作为物质的量的基准。阿伏加德罗常数可以表示为NA,其近似值为6.02×1023 mol-1
19.(2008·全国理综) V、W、X、Y、Z是由周期表中1-20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
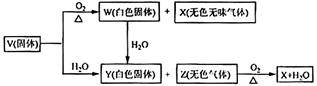
(1)5种化合物分别是V 、W 、X 、Y 、Z :(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 :
(3)V的电子式是 。
[解析]由框图V(固体)+H2O →Y(白色固体)+Z(无色气体),Z(无色气体)+O2→X(无色无味气体)+ H2O可假设V为CaC2,则Y为Ca(OH)2,Z为C2H2,X为CO2,代入可得W为CaO,而CaO+ H2O== Ca(OH)2,且Ca、H、O、C的原子序数之和为35,满足题意,说明假设成立。
[答案](1)V:CaC2 , W:CaO ,X:CO2 ,Y:Ca(OH)2 ,Z:C2H2
 (2)Ca(OH)2+ 2CO2 ==
Ca(HCO3)2 (3)Ca2+
[︰C C︰]2-
(2)Ca(OH)2+ 2CO2 ==
Ca(HCO3)2 (3)Ca2+
[︰C C︰]2-
18.(2008·山东)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
[答案](1)C<O<N (2)三角锥形 sp3
(3)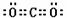 N2O
N2O
(4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) [Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
17.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列是有说法中,不正确的是( )
A.1molNH5中含有5NA个N-H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
 H
H
C.NH5的电子式为:[H:N:H]+[:H]-
H
D.它与水的反应的离子方程式为:NH4++H-+H2O=NH3·H2O+H2↑
[解析]NH5的结构为NH4H
[答案]A
16.(2008·信宜)根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各微粒的电子总数相同,则互称为等电子体。以下各组微粒不是等电子体的是( )
A.CO和N2 B.O3和NO2- C.N2H4和C2H4 D.CO2和 N2O
[解析]C中的电子总数不相等,不满足等电子体的概念。
[答案]C
15.现有aA、bB、cC、dD、eE五种短周期元素,它们都是生物体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素。根据以上信息回答下列有关问题:
(1)请写出下列元素的元素符号: B_____________ D____________ E___________。
(2)写出B、D两元素组成的非极性分子的电子式___________________。
(3)写出由上述五种元素中的四种元素组成的离子化合物的化学式(写出2种即可)
_______________________________、________________________________。
(4)在A、B、D三种元素中选择2种或3种元素,组成2种可发生反应的阴离子,请写出该反应的离子方程式:_________________________________________。
[解析]因A、B、C、D、E是生物体不可缺少的重要元素,故应是C、H、O、N、P等,代入检验即可。
[答案]⑴C、O、P ⑵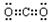
⑶(NH4)2CO3、(NH4)3PO4、NH4HCO3、NH4H2PO4、(NH4)2HPO4等均可
⑷OH-+HCO3-=CO32-+H2O、H2PO4-+2OH-= PO43-+2H2O等均可
能力提高训练
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com