
22.4L/mol是指标准状况(0 ℃,1.01×105Pa)下的气体摩尔体积。命题者有意在题目中设置非标准状况下的气体体积,让考生用22.4L/mol进行换算,误入陷阱。
例如:①常温常压下,11.2L氧气所含的原子数为NA
②在25℃,压强为1.01×105 Pa时,11.2L氮气所含的原子数目为NA
分析:①、②中的气体体积都是非标准状况下的气体体积,不可用标准状况(0 ℃,1.01×105Pa)下的气体摩尔体积(22.4L/mol)来换算,故其叙述是错误的。
陷阱2:物质的状态
4.已知同温同压下与单一气体A的相对密度: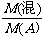 =
=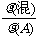
[例4](2008·山东泰安)已知NH4HCO3 NH3+H2O+CO2↑,则150℃时NH4HCO3分解产生的混合气体A的密度是相同条件下H2密度的 倍。
NH3+H2O+CO2↑,则150℃时NH4HCO3分解产生的混合气体A的密度是相同条件下H2密度的 倍。
A.26.3 B.13.2 C.19.8 D.无法计算
[解析]假设NH4HCO3为1 mol,则其质量为79 g ,完全分解产生的气体为3 mol ,故有:M混合气体=79g/3mol =26.3g/mol;又由“相同条件下,气体的密度比等于其摩尔质量比”,故混合气体A的密度是相同条件下H2密度的26.3/2 = 13.2倍。
[答案]B
★ 高考重点热点题型探究
热点1 阿伏加德罗常数
[真题1](2008·广东)设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1molCl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
[解题思路]阿伏加德罗常数是微粒的集合体,其近似值为6.02×1023mol-1,常用符号NA来表示。化学微粒指的是分子、原子、离子、质子、中子、电子等微观粒子。
[解析]Fe过量可使Fe3+还原为Fe2+,故A不正确;3NO2+H2O==2HNO3+NO,易知B正确;C中, 可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果。由方程式3Fe+4H2O===Fe3O4+4H2↑可知D不正确。
[答案]B C
名师指引 阿伏加德罗常数(NA)的常见命题陷阱
陷阱1:温度和压强
3.已知标准状况下混合气体的密度:M(混)=22.4ρ(混)
2.已知混合物各成分的摩尔质量和在混合体系内的物质的量分数或体积分数。
M(混)=M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……
1.已知混合物质的总质量m(混)和总物质的量n(混):M(混)=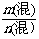
2.阿伏加德罗定律的推论:
(1)三正比:
同温同压下,气体的体积比等于它们的物质的量之比.V1/V2=n1/n2
同温同体积下,气体的压强比等于它们的物质的量之比.p1/p2=n1/n2
同温同压下,气体的密度比等于它们的相对分子质量之比.M1/M2=ρ1/ρ2
(2)二反比:
同温同压下,相同质量的任何气体的体积与它们的相对分子质量成反比.V1/V2=M2/M1同温同体积时,相同质量的任何气体的压强与它们的摩尔质量的反比.p1/p2=M2/M1。
(3)一连比:
同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比,也等于它们的密度之比。m1/m2=M1/M2=ρ1/ρ2
(注:以上用到的符号:ρ为密度,p为压强,n为物质的量,M为摩尔质量,m为质量,V为体积,T为温度;上述定律及其推论仅适用于气体,不适用于固体或液体。)
[例3](2007·全国理综I)在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
[解析]根据阿伏加德罗定律,当它们的温度和密度相同时,摩尔质量与压强成反比,摩尔质量由小到大的顺序为H2<Ne<O2
[答案]D
考点四 混合气体的平均摩尔质量
1.阿伏加德罗定律:
在同温同压下,同体积的气体含有相同的分子数。即:T1=T2;P1=P2
;V1=V2  n1
= n2
n1
= n2
5.数学表达式:气体的摩尔体积= , 即
, 即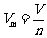
[例2](2009·广州七区联考)下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子的大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
[解析]决定物质体积的因素有:①微粒数的多少②微粒本身的大小③微粒间的距离,其中微粒数的多少是决定物质体积大小的主要因素。对于气体物质,在一定温度和压强下,其体积的大小主要由分子数的多少来决定,故A不正确,B正确;气体的体积随温度和压强的变化而变化。体积不同的气体,在不同的条件下,其分子数可能相同,也可能不同,是无法确定的,故C不正确;气体摩尔体积是指1mol任何气体所占的体积,其大小是不确定的,会随着温度、压强的变化而变化,22.4L/mol是标准状况下的气体摩尔体积,故D不正确。
[答案]B
|
特别提醒: 气体摩尔体积的一个特例就是标准状况下的气体摩尔体积(V0)。在标准状况下,1mol任何气体的体积都约等于22.4 L。在理解标准状况下的气体摩尔体积时,不能简单地认为“22.4 L就是气体摩尔体积”,因为这个22.4 L是有特定条件的。这些条件就是: ①标准状况,即0℃和101.325 kPa,气体的物质的量为1 mol,只有符合这些条件的气体的体积才约是22.4 L。因此,22.4 L是1 mol任何气体在标准状况下的体积。 ②这里所说的标准状况指的是气体本身所处的状况,而不指其他外界条件的状况。例如,“1 mol H2O(g)在标准状况下的体积为22.4 L”是不正确的,因为在标准状况下,我们是无法得到气态水的。 ③1mol任何气体的体积若为22.4 L,它所处的状况不一定就是标准状况。根据温度、压强对气体分子间平均距离的影响规律知,温度升高一倍或压强降低一半,分子间距将增大一倍;温度降低一半或压强增大一倍,分子间距将减小一半。由此可知,1 mol任何气体在0℃ 、101 kPa条件下的体积与273℃ 、202kPa条件下的体积应相等,都约为22.4L。 |
考点三 阿伏加德罗定律及其推论
4.标准状况下,气体摩尔体积约为22.4L/mol
3.单位:L/mol(或L·mol-1)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com