
6.(2007·广雅)在体积为VL的密闭容器中通入amolNO和bmolO2反应后,容器内氮原子和氧原子数之比是( )
A.a∶b B.a∶2b C.a∶(a+2b) D.a∶(2a+2b)
[解析]由元素守恒知:氮原子数为a,氧原子数为(a+2b),故其比为:a∶(a+2b)
[答案]C
5.(2008·黄石二中)两个体积相同的容器,一个盛有NO,一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的( )
A.原子总数 B.质子总数 C.分子总数 D.质量
[解析]NO、N2和O2都是双原子分子,根据阿伏加德罗定律可知A正确。只有当N2和O2的物质的量之比为1︰1时,B、D才正确。
[答案]AC
4.在同温同压下质量相同的X、Y两气体,已知此时V(Y)>V(X),则Mr(Y)和Mr(X)的关系是( )
A.Mr(X)>Mr(Y) B.Mr(X)<Mr(Y) C.Mr(X)=Mr(Y) D.无法确定
[解析]根据题意,因相同质量的X、Y两气体,在同温同压下V(Y)>V(X),也即n(Y)>n(X),则必有Mr(Y)﹤Mr(X)
[答案]A
3. (09年广东理基·20)设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.22.4 L Cl2中含有NA个C12分子
B.1 L 0.1 mol·L-1 Na2SO4溶液中有0.1 NA个Na+
C.1 mol H2与1 mol C12反应生成NA个HCl分子
D.1 mol Ca变成Ca2+时失去的电子数为2NA
答案:D
解析:A选项没有指出条件是否为标准状况;B选项中Na+的物质的量为0.2mol,因此Na+应为0.2NA个;C选项中H2和Cl2反应的化学方程式为H2+Cl2=2HCl,因此1 mol H2与1 mol C12反应生成2NA个HCl分子;D选项中Ca失电子的反应为Ca-2e-=Ca2+,因此1 mol Ca失去2NA个电子数变成Ca2+。所以D选项正确。
2.1.(09年广东理基·20)设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.22.4 L Cl2中含有NA个C12分子
B.1 L 0.1 mol·L-1 Na2SO4溶液中有0.1 NA个Na+
C.1 mol H2与1 mol C12反应生成NA个HCl分子
D.1 mol Ca变成Ca2+时失去的电子数为2NA
答案:D
解析:A选项没有指出条件是否为标准状况;B选项中Na+的物质的量为0.2mol,因此Na+应为0.2NA个;C选项中H2和Cl2反应的化学方程式为H2+Cl2=2HCl,因此1 mol H2与1 mol C12反应生成2NA个HCl分子;D选项中Ca失电子的反应为Ca-2e-=Ca2+,因此1 mol Ca失去2NA个电子数变成Ca2+。所以D选项正确。
1. (09年福建理综·8)设NA为阿伏伽德罗常数,下列叙述正确的是
A.24g镁的原子量最外层电子数为NA
B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
答案:C
解析:A项,镁的最外层电子数为2,故错;B项,乙酸为弱电解质,部分电离,故H+小于0.1NA,错;C项,CH4的质子数为10,正确;D项,乙醇标状下不是气体,错。
2.阿伏加德罗定律及其重要推论的推导:
利用气态方程:pV=nRT=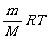 和密度公式:ρ=
和密度公式:ρ=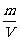 可得如下推论:
可得如下推论:
①同温同压下: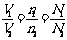
②同温同体积下: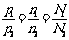
③由同温同压下: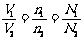 还可推知:
还可推知:
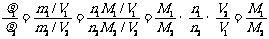 (也称为气体1相对于气体2的密度)
(也称为气体1相对于气体2的密度)
新题导练3
3-1.在标准状况下,ag气体A与bg气体B的分子数相同,则与此有关的以下说法中不正确的是( )
A.气体A与气体B的摩尔质量之比为a:b
B.相同状况下,同体积的气体A与气体B的质量之比为a:b
C.质量相同的气体A与气体B的分子数之比为b:a
D.同温同压下,气体A与气体B的密度之比为b:a
[解析]根据题意,有:选项A: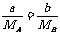 =nA=nB,∴MA:MB=a:b
;选项B:同体积气体的质量比,即为密度比,
=nA=nB,∴MA:MB=a:b
;选项B:同体积气体的质量比,即为密度比,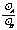 =
=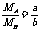 (见A);选项C: m(A)=m(B)
(见A);选项C: m(A)=m(B)
 D.
D. 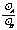 =
=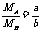
[答案]D
3-2.(2008·北京海淀)在120℃时分别进行如下四个反应:
A.2H2S + O2 = 2H2O + 2S B.2H2S + 3O2 = 2H2O + 2SO2
C.C2H4 + 3O2 = 2H2O + 2CO2 D.C4H8 + 6O2 = 4H2O + 4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(P)分别符合关系式d前=d后和P前>P后的是 ;符合关系式d前=d后和P前=P后的是 (请填写反应的代号)。
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合d前>d后和V前<V后的是 ;符合d前>d后和V前>V后的是 ;(请填写反应的代号)。
[解析]本题是典型的阿伏加德罗定律及其推论的应用题,要注意在120℃时,水是气态。当容积固定时,若要求反应前后d前=d后,则反应应该是在反应条件下反应前后都是气体,符合此条件的反应有B、C、D,若要求反应前后P前>P后,则要求反应后气体n前>n后,即反应物化学式前系数和要大于生成物化学式前系数和,也即为反应为总物质的量缩小的反应,符合此条件的只有反应B了。同理,分析出符合关系式d前=d后和P前=P后的反应是C。
当反应在压强恒定、容积可变的容器内进行,若要d前>d后,则要求①若反应前后物质均为气态,即反应前后气体总质量不变,则当反应为总体积增大时满足条件;②若反应前后气态物质质量有变化,则需要同时考虑质量的变化和体积的变化,即根据密度定义来讨论。根据题给的四个反应,就容易判断出符合条件的反应分别是D、A。
[答案](1)B;C (2)D;A
热点4 有关混合气体平均摩尔质量的计算
[真题4](2008·海南)由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中,CO2、H2和CO的体积比为( )
A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
[解析]根据题意,由“CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同”可知,CO2、H2和CO组成的混合气体的平均摩尔质量为28g/mol;又,CO的摩尔质量为28g/mol,这说明所形成混合气体中CO的体积可为任意体积,故有:
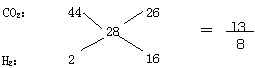
[答案]C D
名师指引
|
|
|

|
|
|

新题导练4
4-1.(2008·江西信丰中学)用蒸汽密度法测定物质的相对分子质量是一种常用的方法。现测得0.3g某挥发性液体化合物样品在挥发时排出的空气在标准状况下是40mL,则该化合物的相对分子质量是( )
A.85 B.168 C.310 D.340
[解析]排出空气的体积即为液体混合物蒸气的体积,故有:
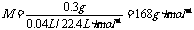
[答案]B
4-2.(2008·重庆二模)在有机溶剂里,使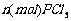 与
与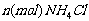 发生完全反应,释放出
发生完全反应,释放出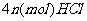 ,同时得到一种白色晶体A,A的熔点为113℃,在减压时,50℃即可升华,测得A蒸气的密度(标准状况)为
,同时得到一种白色晶体A,A的熔点为113℃,在减压时,50℃即可升华,测得A蒸气的密度(标准状况)为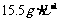 。
。
(1)通过计算得出A的化学式_____ ______。
(2)生成A晶体的化学方程式为______ _______。
(3)分子结构测定结果表明,同种元素的原子在A分子中所处的环境毫无差别,试写出A的结构式:______ ______。
[解析]根据题意先算出A的摩尔质量,然后结合化学方程式写出A物质的化学式即可。物质A的摩尔质量为:22.4L/mol×15.5g/L = 347.2 g/mol;则PCl5和NH4Cl等物质的量反应的化学方程式为: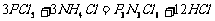 。又因所发生的反应是非氧化还原反应,A中P为+5价,N为-3价,Cl为-1价,各元素的化合价在反应前后均不变,且“分子中A所处的环境毫无差别”,从而可得A的结构式(见答案)。
。又因所发生的反应是非氧化还原反应,A中P为+5价,N为-3价,Cl为-1价,各元素的化合价在反应前后均不变,且“分子中A所处的环境毫无差别”,从而可得A的结构式(见答案)。
[答案](1)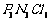 (2)
(2)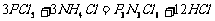 (3)
(3)
★抢分频道
限时基础训练
1.公式、定律的使用切忌死记硬背,胡乱套用。运用时宜根据题目的需要去进行合理的推导。阿伏加德罗定律的推论很多,如靠记忆去答题,难免会出错,但如能根据题目的需要用理想气体状态方程去推导求解,则就会准确得多。
22.4L/mol是标准状况下的气体摩尔体积,运用时要注意其特定条件:
①标准状况,即0℃、101.325 kPa 或0℃、1atm
②1 mol气体。这里所说的气体,是指物质在标准状况时本身的状态,而不指其他外界条件的状况。如“1 mol H2O(g)在标准状况下的体积为22.4 L”是不正确的,因为在标准状况下,我们是无法得到气态水的。
新题导练2
2-1.(2008·江西彭泽二模)NA为阿伏加德罗常数,下列说法中不正确的是( )
A.3.2g S2和S8含有硫原子的个数为0.1NA
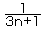 B.含NA个化学键的CnH2n+2分子的物质的量为 mol
B.含NA个化学键的CnH2n+2分子的物质的量为 mol
C.标况下,11.2L CO2分子中含有双键数约为NA
 D.1molFe与一定量HNO3中恰好完全反应,则转移的电子数一定为3 NA
D.1molFe与一定量HNO3中恰好完全反应,则转移的电子数一定为3 NA
[解析] 1molFe与一定量HNO3中恰好完全反应,Fe可能转化为+2或+3,转移的电子数为2NA -3 NA之间。
[答案]D
2-2.(2008·重庆二模)测定1mol氧气在标准状况下所占体积的实验操作步骤如下:
①按下图装配实验装置。
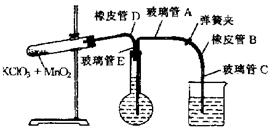
②洗净试管然后充分干燥。
③向500mL烧瓶里装满水,烧杯中也装入少量的水。把连接烧瓶和烧杯的玻璃管A,橡胶管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡胶管B夹紧。
④称得试管的质量14.45g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置放置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用量筒测量烧杯里水的体积为285.0mL,把它换算为标准状况下氧气的体积279.7mL。
⑩再称量冷却后试管的质量为15.55g。
根据上述实验,回答下列问题:
(1)在操作⑦中,装置冷却时,玻璃管C的出口,一直要在烧杯的水中,不能离开水面其理由是 。
(2)简述操作⑧的必要性,即为什么要调 节烧杯的高度,使烧瓶和烧杯中的水面一致?答 :
(3)标准状况下1mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
[答案](1)温度降低时,烧瓶中的压强降低,这时烧杯中的水就会回流,从而使测定出的气体的体积准确。(2)如果烧瓶中的压强和外界大气压不一致,测定出的气体体积就不准确。(3)22.38 ;32% 或0.32
热点3 阿伏加德罗定律及其推论
[真题3](2008·江苏)下列各组中两种气体的分子数一定相等的是( )
A.同质量、同体积的O2和N2 B.同质量、密度不等的N2和C2H4
C.同体积、同密度的CO和C2H4 D.同压、同体积的O2和N2
[解析]虽然O2和N2的 同质量相同,但因它们的摩尔质量不同,所以其分子数目也就不同,故A不正确;由pV=nRT易知,在同压、同体积条件下,O2和N2的物质的量之比与温度成反比,因其温度不定,所以它们的分子数目也就无法确定。
[答案]B C
名师指引
22.4L/mol使用的对象是气体(包括混合气体)。命题者常把一些容易忽视的液态或固态物质作为气体来命题,让考生落入陷阱。
例如:①标准状况下,22.4L辛烷完全燃烧,生成的CO2的分子数为8NA
②标准状况下,11.2L四氯化碳所含的分子数为0.5NA
③标准状况下,1L水所含的分子数为(1/22.4)NA
④标准状况下,11.2L SO3中含有1.5NA个氧原子
分析:①、②、③中的辛烷、四氯化碳、水在标准状况下均为液体,而④中的SO3在标准状况下为固体,与标准状况下的气体摩尔体积的定义不符。故以上4道题的说法都不正确。
陷阱3:单质的组成
气体单质的组成除常见的双原子分子外,还有单原子分子(如Ne)、三原子分子(如O3)、四原子分子(如P4)等;考生如不注意这点,容易误入陷阱。
例如:①标准状况下,11.2L臭氧中含NA个氧原子
②10g氖气所含原子数为NA
③在同温同压时,相同体积的任何气体单质所含的原子数目相同
分析:臭氧(O3)为三原子分子,n(O)= 3n(O3)=1.5mol,即11.2LO3中含有1.5NA个氧原子,故①叙述错误。氖气(Ne)为单原子分子,10g Ne为0.5mol,所含原子数为0.5mol NA,故②叙述错误。因为组成气体单质的原子数目不同,故③叙述错误。若说成“在同温同压时,相同体积的任何气体单质所含的分子数目相同”则正确。
陷阱4:粒子的数目
粒子种类一般有分子、原子、离子、质子、中子、电子等。1mol微粒的数目即为阿伏加德罗常数,由此可计算分子、原子、离子、质子、中子、电子等微粒的数目。命题者往往通过NA与粒子数目的换算,巧设陷阱。
例如:①53g碳酸钠中含NA个CO32-
②1.8g重水(D2O)中含NA个中子
③1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
分析:53gNa2CO3的物质的量为53g/106g·mol-1 = 0.5mol,即53gNa2CO3中含0.5NA个CO32-,故①叙述错误。H、D、T互为氢元素的三种同位素,三种原子的中子数不同,质子数相同。1.8gD2O物质的量为(1.8/20)mol,所含中子数为0.9NA,故②叙述错误。盐酸溶液中无HCI分子,因HCI分子在水分子作用下全部电离成H+和CI-,故③叙述错误。
陷阱5:物质的结构
Na2O2是由Na+ 和O22-构成,而不是Na+ 和O2-;SiO2、SiC为原子晶体,其结构中只有原子,无分子;SiO2为正四面体结构,1molSiO2中含有的共价键数为4NA,P4也为正四面体结构,1mol P4分子中含有的共价键数为6NA。考生如不注意这点,容易误入陷阱。
例如:①60gSiO2含有NA个SiO2分子
②7.8gNa2O2中含有0.2NA个Na+ ,0.1NA个O2-
③60gSiO2含有的共价键数为2NA
④1molP4分子中含有的共价键数为4NA
分析:SiO2为原子晶体,其结构中只有原子,无分子,故①叙述错误。Na2O2是由Na+ 和O22-构成,而不是Na+ 和O2-;故②叙述错误。SiO2为正四面体结构,1molSiO2中含有的共价键数为4NA,故③叙述错误。P4为正四面体结构,1mol P4分子中含有的共价键数为6NA,故④叙述错误。
陷阱6:物质的变化
一些物质间的变化具有一定的隐蔽性,有时需要借助方程式分析才能挖掘出隐含的变化情况。考生若不注意挖掘隐含变化往往会误入陷阱。
例如:①2.4g金属镁变为镁离子时失去的电子数为0.1NA
②常温常压下,1molNO2气体与水反应生成NA个NO3-
③62gNa2O溶于水后所得溶液中含有O2-离子数为NA
④在铜与硫的反应中,1mol铜失去的电子数为2NA
⑤100mL 2mol/L的AlCl3溶液中含Al3+的数目为0.2NA
⑥500mL 1mol/L碳酸钠溶液中含0.5NA个CO32-
分析:2.4gMg其物质的量为0.1mol,据Mg-2e → Mg2+,可知2.4gMg变为Mg2+时失去的电子数为0.2NA,故①叙述错误。据化学方程式3NO2+H2O=2HNO3+NO可知,1mol NO2气体与水反应生成(2/3)mol NO3-离子,即为(2/3)NA个NO3-离子,故②叙述错误。Na2O溶于水后发生反应Na2O+H2O=2NaOH,所得溶液中不含有O2-离子,故③叙述错误。Cu与S反应的方程式为2Cu+S=Cu2S,Cu的化合价由零价升为+1价,2mol Cu失去2NA个电子转变为Cu+离子,则1molCu失去的电子数为NA,故④叙述错误。在AlCl3溶液中,Al3+会发生水解而消耗,使其离子数目小于0.2NA,故⑤叙述错误。同理,在碳酸钠溶液中,因CO32-水解消耗,使其离子数目小于0.5NA,故⑥叙述错误。
新题导练1
1-1.(2007·广东)下列叙述正确的是( )
A.48gO3气体含有6.02×1023个O3分子
B.常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
[解析]解题时要注意回忆概念、分析原理注意运算公式的适用范围。B选项4.6gNO2气体中理论上含有1mol NO2分子,约6.02×1023个NO2分子,由于2NO2 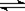 N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
[答案]A
1-2.(2008·江西师大附中、鹰潭一中联考)NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2L四氯化碳所含分子数为0.5NA
B.pH=2、体积为1L的醋酸溶液中含醋酸分子的数目为0.01NA
C.7.8g Na2O2中阴、阳离子总数为0.4NA
D.4.5g SiO2晶体中含有的硅氧键数目为0.3NA
[解析]标准状况下,四氯化碳为液态,不可以用22.4L/mol来换算,故A不正确;醋酸为弱电解质,在溶液中部分电离,0.01NA是溶液中H+的数目,故B不正确;Na2O2中的阴离子为O22-,7.8g Na2O2中的物质的量为0.1mol,其阴、阳离子总数为0.3NA,故C不正确。
[答案]D
热点2 气体摩尔体积
[真题2](2008·山东) NA表示阿伏加德罗常数,以下说法正确的是( )
A.常温常压下,16g氧气中含有氧原子的数目为NA
B.25℃,压强为1.01×105 Pa时,11.2L氮气所含的原子数目为NA
C.标准状况下,11.2L四氯化碳所含的分子数为0.5NA
D.标准状况下,11.2L SO3中含有1.5NA个氧原子
[解析]B中的气体体积是非标准状况下的气体体积,不可用标准状况(0 ℃,1.01×105Pa)下的气体摩尔体积(22.4L/mol)来换算,故B叙述不正确;C中的四氯化碳在标准状况下为液体,D中的SO3在标准状况下为固体,与标准状况下的气体摩尔体积的定义不符。故C、D都不正确。
[答案]A
名师指引
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com