
16.(2008·上海)生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO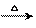 CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通入足量的澄清石灰水中,充分反应吸收,生成沉淀8.5g,则:
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通入足量的澄清石灰水中,充分反应吸收,生成沉淀8.5g,则:
(1)原混合气体中甲烷的物质的量是 。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
[解析]根据题意,2.016L(标准状况)混合气体的物质的量为:2.016/22.4 = 0.090 mol
(1)由方程式CH4+4CuO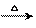 CO2+2H2O+4Cu可知,玻璃管质量减轻的4.8g为CuO中氧的质量,故原混合气体中甲烷的物质的量为:4.8/(16×4)=0.075mol
CO2+2H2O+4Cu可知,玻璃管质量减轻的4.8g为CuO中氧的质量,故原混合气体中甲烷的物质的量为:4.8/(16×4)=0.075mol
(2)由“将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5g”可知,反应后气体中CO2的物质的量为:8.5/100 =0.085 mol,则原混合气中CO2的物质的量为:0.085 mol- 0.075mol = 0.010mol,故原混合气体中氮气的物质的量为:0.090 mol- 0.075mol - 0.010mol = 0.005mol,从而可得原混合气体中氮气的体积分数为:
15.(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
答案:C
解析:A中镁为0.1mol,失去的电子数为0.2 NA;B中盐酸无体积,不能计算出粒子数;D选项中使用气体摩尔体积不是在标准状况下。
14.(09年山东理综·10)下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若35 17Cl、37 17若Cl为不同的核素,有不同的化学性质学科
C.实验室制备Cl2,可用排放和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
答案:C
解析:本题以氯元素为载体,从氧化还原、原子结构、收集方法不同角度进行考查,体现了山东理综化学选择题的命题模式。氯气与水的反应既是氧化剂也是还原剂;同一元素的不同核素化学性质几乎完全相同而物理性质不同;D中提Cl2的体积未指明是标准状况。实验室制备Cl2,可用排饱和食盐水集气法收集也可用瓶口向上排空气法收集,故C正确。
13.(09年宁夏理综·7)将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O2 C.N2O D.N2O4
答案:A
解析:根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
[点评]本题主要考查气体摩尔体积,阿伏伽德罗常数等知识,题目较为老套,而且这种题目在若干年前就已经经常出现了。
12.(09年江苏化学·4)用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
答案:C
解析:A项,pH=13也就是意味着c(H+)=1×10-13mol·L-1,则c(OH-)=1×10-1mol·L-1,所以n(OH-)=n(OH-)×V=1×10-1mol·L-1×1L=0.1mol,所以N(OH-)=0.1NA;B项,发生的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O(该反应为歧化反应),n(Cl2)=0.1mol,那么转移电子的数目应该为0.1NA;C项,乙烯和丁烯的最简式都是CH2,则n(CH2)=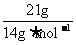 =1.5mol,所以n(C)=01.5mol,N(C)=1.5NA;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是1mol,则所含有的氧原子个数也不为NA。
=1.5mol,所以n(C)=01.5mol,N(C)=1.5NA;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是1mol,则所含有的氧原子个数也不为NA。
[考点分析]以阿伏伽德罗常数为载体考察如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算;③正确表示一定物质的量的某物质微粒所含某种微粒的个数;④考查在标准状况下一定体积的气体分子所含的分子数和原子数。
11.2.(09年广东化学·6)设NA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3NA 个氢原子
C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
答案:C
解析: K2SO4中阴离子为硫酸根,1mol硫酸根所带电荷为2mol,A错误。乙烯和C3H6的最简式相同均为CH2,28g混合气有2molCH2,所以含4molH原子,B错误。Fe3+在溶液中发生水解,0.1molFeCl3溶液中,Fe3+的物质的量要小于0.1mol,D错误。
10.(2007·江苏启东)同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )
A.体积比为1∶1 B.体积比为11∶16
C.密度比为16∶11 D.密度比为11∶16
[解析]设SO2和CO2的质量各为1g。则其物质的量分别为:n(SO2)=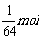 ,n(CO2)=
,n(CO2)=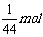 ,根据阿伏加德罗定律有:
,根据阿伏加德罗定律有: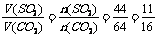 ;
; 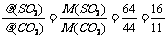
[答案]B C
基础提升训练
9.(2008·海南)在两个密闭容器中,分别充有质量相等的甲乙两种气体。若两容器的温度和压强均相等,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
[解析]由理想气体状态方程PV=nRT可知,当两容器的温度和压强均相等时,气体的体积V与气体的物质的量n成正比,又因为甲的密度大于乙的密度,而甲、乙两种气体的质量相等,故甲气体的体积小于乙气体的体积,甲的物质的量小于乙的物质的量,故B正确,A、D不正确;因为两容器的温度和压强均相等,所以甲乙两气体的摩尔体积也相等,故C也不正确。[答案]B
8.(2008·江西南昌二中)下列各物质中所含原子个数由大到小的顺序正确的是( )
①0.5mol氨气;②标准状况下22.4L氦气;③4℃时9mL水;④0.2mol磷酸
A.①④③② B.④③②① C.②③④① D.①④②③
[解析]所含原子数依次为①0.5×4=2mol ②2mol(单原子分子)
③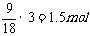 (4℃时水的密度
(4℃时水的密度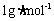 ) ④0.2×8=1.6mol
) ④0.2×8=1.6mol
[答案]A
7.(2006·广东)等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2mol·L-1H2SO4溶液 B.18 mol·L-1H2SO4溶液
C.6 mol·L-1KOH溶液 D.3 mol·L-1HNO3溶液
[解析]B中18 mol·L-1H2SO4溶液为浓硫酸,它和D中的HNO3溶液与镁铝合金反应都不会放出氢气,故BD错;又因为反应时镁铝合金等量且不足,而镁又不能与KOH溶液反应,故易知答案为A
[答案]A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com