
2.配平步骤(以高锰酸钾和浓盐酸反应制氯气为例):
①标出化合价变化了的元素的化合价。如:
+7 -1 +4 0
KMnO4+HCl==KCl+MnCl2+Cl2↑+H2O
②根据元素存在的实际形式调整发生了氧化还原反应的物质的系数,使之成1︰1的关系。如:+7 -1 +4 0
KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
③调整系数,使化合价升降总数相等。
 化合价↓ 5×②
化合价↓ 5×②
 KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
化合价↑2×⑤
④根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。如:2KMnO4+10HCl==KCl+2MnCl2+5Cl2↑+H2O
⑤利用元素守恒,用观察方法配平没有参加氧化还原反应的其他物质的系数。如:
2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O
⑥检查方程式两边各原子的个数是否相等,离子方程式还要检查方程式两边的离子所带的电荷数是否相等。
[例3](2008·江西信丰中学)对于反应KMnO4+HCl→KCl+MnCl2+Cl2+H2O(未配平),若有0.1mol KMnO4参加反应,下列说法正确的是( )
A.其转移电子0.5mol B.生成Cl20.5mol
C.参加反应HCl为16mol D.Cl2是还原产物
[解析]配平该方程式为:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O ,Mn由+7→+2,得到5电子,则0.1mol KMnO4参加反应消耗HCl为1.6mol,转移的电子为0.5mol,生成的Cl2为0.25mol,故A正确,B、C不正确;Cl2是氧化产物,故D不正确。
[答案]A
考点四 电子转移守恒应用
电子转移守恒法是依据氧化剂与还原剂得失电子数目相等这一原则进行计算的。电子转移守恒法是氧化还原反应计算的最基本的方法。
[例4](2007·广州·学业水平测试)在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A.l∶1∶1 B.2∶2∶1 C.2∶3∶1 D.4∶3∶2
[解析]用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢制氧气,O则由-1价转化为0价。现要制得相同的O2,所以用过氧化氢制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半。
[答案]B
★ 高考重点热点题型探究
热点1 氧化还原反应、氧化剂、还原剂、氧化产物、还原产物判断
[真题1](2006·广东)下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是( )
A.O3+2KI+H2O=2KOH+I2+O2 B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2Ca
C.I2+2NaClO3=2NaIO3+Cl2
D.4HCl+MnO2=MnCl2+Cl2↑+2H2O
[解题思路]根据氧化还原反应规律,正确判断氧化剂与还原剂,由方程式的系数确定出它们的物质的量,再求比即可。
[解析]反应A中氧化剂为O3,还原剂为KI,从方程式系数易知,其物质的量之比为1∶2;反应B为非氧化还原反应;反应C中氧化剂为NaClO3,还原剂为I2,从方程式系数易知,其物质的量之比为2∶1;反应D中氧化剂为MnO2,还原剂为HCl,但4molHCl中只有2molHCl作还原剂。故答案为A D。
[答案]A D
名师指引
氧化还原反应一般可分为以下几种类型:
1.配平原则:电子守恒、原子守恒、电荷守恒
10.根据(氧化剂、还原剂)元素的价态进行判断:
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
一般来说,同种元素价越高,氧化性越强;价越低还原性越强。如氧化性:Fe3+>Fe2+>Fe,
S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4< HClO34< HClO24< HClO。
注意:①物质的氧化性、还原性不是一成不变的。同一物质在不同的条件下,其氧化能力或还原能力会有所不同。如:氧化性:HNO3(浓)>HNO3(稀);Cu与浓H2SO4常温下不反应,加热条件下反应;KMnO4在酸性条件下的氧化性比在中性、碱性条件下强。
②原子的氧化性一般都强于分子的氧化性。如:氧化性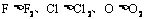 等。
等。
[例2](2007·聊城二模)常温下,在下列溶液中发生如下反应
①16H++10Z-+2XO4-=2x2++5Z2+8H2O ②2A2+ +B2=2A3++2B- ③2B-+Z2=B2+2Z- 由此判断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行。 B.Z元素在①③反应中均被还原
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
[解析]根据上述规律4可得:氧化性顺序:XO4->Z2>B2>A3+,还原性顺序:A2+>B->Z->X2+。
[答案]B
考点三 氧化还原反应方程式的配平方法
9.根据元素在周期表中位置判断:
(1)对同一周期金属而言,从左到右其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
(2)对同主族的金属而言,从上到下其金属活泼性依次增强。如Li、Na、K、Rb、Cs金属活泼性依次增强,其还原性也依次增强。
(3)对同主族的非金属而言,从上到下其非金属活泼性依次减弱。如F、Cl、Br、I非金属活泼性依次减弱,其氧化性也依次减弱。
8.根据电解池中溶液里阴、阳离子在两极放电顺序来判断。
如:Cl-失去电子的能力强于OH-,还原性: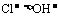 。
。
7.根据原电池的正负极来判断:
在原电池中,作负极的金属的还原性一般比作正极金属的还原性强。
6.根据被氧化或被还原的程度来判断:
如: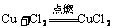 ,
,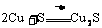 , 即氧化性:
, 即氧化性: 。
。
又如: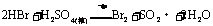 ,
,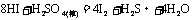 ,
,
即有还原性: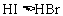 。
。
5.根据反应速率的大小来判断:
如:2Na2SO3+O2=2Na2SO4(快), 2H2SO3+O2=2H2SO4(慢), 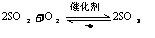 ,
,
其还原性: Na2SO4>H2SO3>SO2
4.根据氧化还原反应发生的条件来判断:
 如:Mn02+4HCl(浓) MnCl2+C12↑+2H20
如:Mn02+4HCl(浓) MnCl2+C12↑+2H20
2KMn04+16HCl(浓)=2MnCl2+5C12↑+8H2O
后者比前者容易(不需要加热),可判断氧化性 KMn04>Mn02
3.根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:
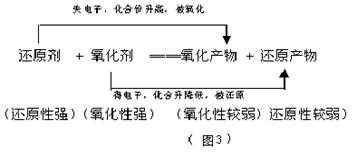
规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com