
4.下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A.Na+、Ba2+、Cl-、SO42- B.Ca2+、HCO3-、C1-、K+
C.MnO4-、K+、I-、H+ D.H+ 、Cl- 、Na+ 、CO32-
[解析]B可以共存;AD不能共存,但不是因为发生氧化还原反应。
[答案]C
3.由相同条件下的三个反应:2A-+B2=2B-+A2 ;2C-+A2=2A-+C2 ;2B-+D2=2D-+B2可以判断正确的是( )
A.氧化性:A2>B2>C2>D2 B.还原性:A->B->C->D-
C.2A-+D2=2D-+A2反应可以进行 D.2C-+B2=2B-+C2反应不能进行
[解析]由2A-+B2=2B-+A2 ,2C-+A2=2A-+C2,2B-+D2=2D-+B2知:氧化性顺序:D2>B2>A2>C2,还原性顺序:C->A->B->D-,故C正确。
[答案]C
2.(2007·全国)下列氧化还原反应中,水作为氧化剂的是( )
A.CO+H2O ==CO2+H2 B.3NO2+H2O=2HNO3+NO
C.2Na2O2+2H2O=4NaOH+O2↑ D.2F2+2H2O=4HF+O2
[解析]H2O中所含元素化合价降低的反应,水就作为氧化剂,BC中水没有参加氧化还原反应。 [答案]A
1.氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是( )
A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐
[解析]有化合价变化的反应为氧化还原反应,D中无价态变化。
[答案]D
2.一种氧化剂(还原剂)对多种还原剂(氧化剂)或多种氧化剂对多种还原剂的氧化还原反应问题;发生在同种元素不同价态间的氧化还原反应问题等是本讲的易错点,回答此类问题的关键是要理清楚反应中各元素的来源和去向,理清楚氧化还原反应中电子得失或化合价升降总数的整体相等和局部相等。
新题导练4
4-1.(2008·江西九江)等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是( )
A.KClO3(加MnO2催化剂,加热) B.KMnO4加热
C.H2O2(水溶液,加MnO2催化剂) D.HgO(加热)
[解析]假设它们都为1 mol,由对应的分解方程式可知答案为A
[答案]A
[解析]阳极上产生的气体为O2,其物质的量为0.0100 mol,则转移的电子为0.0400 mol,故在阴极上析出Cu的质量为:0.0200 mol×64g/mol=1.28g
[答案]B
4-2.(2008·湖北沙市三中)已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。测得产物中NO2与O2的体积比为6∶1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是( )
A.升高 B.降低 C.不变 D.不能确定
★抢分频道
限时基础训练
1.只要是氧化还原反应,不管该过程是通过一步,还是通过多步去实现,在整个过程中一定会有参加氧化还原反应的元素的化合价升降总数或电子得失总数相等。
4.归中反应:指含不同价态同种元素的物质问发生氧化还原反应。其反应规律是:反应物中,该元素一部分价态升高,一部分价态降低,该元素价态的变化一定遵循“高价+低价
→中间价”,而不会出现交错现象。如:KClO3+6HCl==KCl+3Cl2+3H2O ;对于归中反应,可
通过分析参加氧化还原反应的元素的来源,从而确定氧化产物、还原产物的物质的量之比。
新题导练1
1-1.(2008·深圳调研)已知硫酸锰(MnSO4) 和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3)此反应的离子反应方程式可表示为:
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
|
[答案](1)2MnSO4+5K2S2O8+8H2O === 2KMnO4+4K2SO4+8H2SO4
|
(3)2Mn2++5S2O82-+8H2O === 2MnO4-+10SO42-+16H+ (4)Cl2
 1-2.(2008·黄石二中)用双线桥表示下列氧化还原反应,标出反应前后化合价升降情况和被氧化、被还原情况及电子转移的方向和数目
1-2.(2008·黄石二中)用双线桥表示下列氧化还原反应,标出反应前后化合价升降情况和被氧化、被还原情况及电子转移的方向和数目
(1)MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑还原剂 还原产物 。
(2)2K+2H2O=2KOH+H2↑氧化剂 ,氧化产物 。
[答案](1)还原剂是HCl;还原产物是MnCl2;

|
 MnO2+4HCl(浓)
=== MnCl2+2H2O+Cl2↑
MnO2+4HCl(浓)
=== MnCl2+2H2O+Cl2↑
|
|

 (2)氧化剂是H2O;氧化产物是KOH
; 2K +2H2O=2KOH+H2↑
(2)氧化剂是H2O;氧化产物是KOH
; 2K +2H2O=2KOH+H2↑
热点2 氧化剂的氧化性、还原剂的还原性强弱判断
[真题2](2007·济宁一模)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2=2FeCl3+4FeI3 B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2Fe3++2I-=2Fe2++I2
[解题思路]反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。故要发生反应,必须是反应物的氧化性强于氧化产物的氧化性。
[解析]A中因I-的还原性强于Fe2+,Cl2应先氧化I-,只有当I-氧化完全后才会氧化Fe2+,故A不正确,B正确。C、D中的物质的氧化性顺序都符合题给要求,也是正确的。
[答案]A
名师指引
同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性较强的物质;同一还原剂与含多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性较强的物质。如:将Cl2通人物质的量浓度相同的NaBr和NaI的混合液中,C12首先与NaI反应;将过量铁粉加入到物质的量浓度相同的Fe2+、和Cu2+的混合溶液中,Fe首先与Fe3+反应。FeBr2 中通入Cl2 ,Fe2+首先与Cl2反应;FeI2 中通入Cl2 ,I-首先与Cl2反应。
新题导练2
2-1.(2008·上海)下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是( )
A.F2、K、HCl B.Cl2、Al、H2 C.NO2、Na、Br2 D.O2、SO2、H2O
[解析]A中F的化合价只能降低,单质F2只有氧化性,K的化合价只能升高,单质K只有还原性,HCl中H的化合价可以降低,而Cl的化合价可以升高,HCl既有氧化性,又有还原性;B中Cl2既有氧化性,又有还原性,H2只有还原性;C中NO2、Br2都既有氧化性,又有还原性;D中SO2既有氧化性,又有还原性。
[答案]A
2-1.有一瓶无色气体可能有H2S、CO2、HCl、HBr、SO2五种气体中的一种或几种。将其通入氯水中,得无色透明溶液。将这种溶液分为两份。向一份中加入用盐酸酸化的BaCl2溶液,产生了白色沉淀。向另一份中加入用硝酸酸化的AgNO3溶液,产生了白色沉淀,则下列结论中正确的是( )
A.肯定有HCl、SO2 B.可能有HBr、CO2
C.肯定没有CO2、H2S、HBr D.以上结论都不正确
[解析]将气体通入氯水中,得无色透明溶液,说明混和气体中无H2S、HBr,有SO2;将这种溶液分为两份。一份中加用盐酸酸化的BaCl2溶液,产生了白色沉淀,这进一步证明有SO2;另一份中加用硝酸酸化的AgNO3溶液,虽然产生了白色沉淀,但不能说明原气体中有HCl,因为开始时已将气体通入到了氯水中;至于原气体中有没有CO2则无法证明。
[答案]D
热点3 氧化还原反应方程式的配平
[真题3](2008·全国理综)(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3,在该反应的化学方程式中,化学计量数由小到大的产物分子依次是( )
A.SO2、H2O、N2、NH3 B.N2、SO2、H2O、NH3
C.N2、SO2、NH3、H2O D.H2O、NH3、SO2、N2
[解析]根据题意,题设中的氧化还原方程式的配平如下:
3(NH4)2SO4 = 3SO2↑+N2↑+4NH3↑+6H2O 故答案为C
[答案]C
名师指引
电子转移守恒法(化合价升降价法)只是配平氧化还原反应方程式的方法之一,“设1法”、“ 设1,x法”也不失为氧化还原反应方程式配平的一种好的方法,至于方法的使用,则大家可以根据所需配平的氧化还原方程式的特点去进行合理的选择,采用不同的方法。
现以KMnO4和HCl反应(KMnO4+HCl → KCl+MnCl2+Cl2↑+H2O)为例来加以说明。
假设KMnO4的系数为1,由元素守恒知,KCl和MnCl2的系数都为1,H2O的系数为4;又由H2O的系数为4可得HCl的系数为8,再由Cl守恒可知Cl2的系数为2.5,然后方程式左右两边再同×2可得方程式为:2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
同理,如果“设1法”不能配平,则可以通过“ 设1,x法”或“ 设1,x,y … 法”等去进行处理。
新题导练3
3-1.(2006·天津)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
□MnO4- +□Fe2+ +□H+=□Mn2++□Fe3++□H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL0.1 mol/LFe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中Cu2S的质量分数为 。
[解析](1)MnO4-+Fe2++H+=Mn2++Fe3++H2O
化合价变化:Mn:+7 → +2 ↓ 5×①
Fe:+2 → +3 ↑ 1×⑤
故:1MnO4-+5Fe2++H+=1Mn2++5Fe3++H2O
应观察法配平其他系数得:1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(2)nKMnO4=0.350L×0.1mol/L/5 = 0.007mol
(3)m(NH4)2Fe(SO4)2·6H2O=0.500L×0.1 mol/L×392g/mol=19.6g
(4)假设Cu2S、CuS分别为xmol,ymol
则有: 160x + 96y = 2
8x/5 + 6y /5 = 0.4×0.075-0.007
解得:x=0.005mol; y=0.0125mol
故:mCu2S﹪=0.005×160/2 ×100﹪= 40﹪
[答案](1)1 5 8 → 1 5 4 ;(2) 0.007; (3)19.6;(4)40﹪
3-2.配平以下氧化还原反应方程式:
□KMnO4+□H2C2O4+□H2SO4 □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
当KMnO4消耗0.05mol时,产生的CO2的体积为______L(标准状况)。
[答案]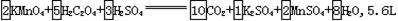
热点4 电子转移守恒的运用
[真题4](2008·海南)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2mol B.1 mol C.0.5mol D.0.25mol
[解析]每生成1mol硝酸锌时,Zn的化合价升高2价,而1 molHNO3被还原成硝酸铵,N元素的化合价降低8价,由电子转移守恒可知,在氧化还原反应中化合价升高总数与化合价降低总数相等,则每生成1 mol硝酸锌时,被还原的HNO3的物质的量为0.25mol。
[答案]D
名师指引
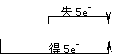
3.歧化反应:指发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应。其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:
 得5e-
得5e-
Cl2 + 2NaOH==NaCl+ NaClO+H2O;对于歧化反应,可通过分析参加氧化还原反应的元素的去
 失5e-
失5e-
向,从而确定氧化剂、还原剂的物质的量之比。
2.自身氧化还原反应:指氧化剂和还原剂属于同一种物质的氧化还原反应。如:实验室用氯酸钾和二氧化锰加热制氧气,氯气和水的反应等等。
1.一般的氧化还原反应:指氧化剂和还原剂分别属于不同物质的氧化还原反应。如:
H2还原氧化铜,实验室用二氧化锰和浓盐酸反应制氯气等等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com