
14.(2005·江苏)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C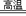 2AlN+3CO,下列叙述正确的是 ( )
2AlN+3CO,下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2mol AlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3价
D.氮化铝晶体属于分子晶体
[解析]A中在N2是氧化剂,Al2O3没有参加氧化还原反应;B中每生成2mol AlN,N2得到6mol电子;D中氮化铝晶体属于原子晶体。
[答案]C
13.(2008·江西金太阳第6次全国大联考)某工厂的酸性废水中含有剧毒的 可加入
可加入 除去
除去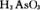 并回收As,反应的离子方程式为:
并回收As,反应的离子方程式为: ,下列关于该反应的说法中正确的是( )
,下列关于该反应的说法中正确的是( )
A.还原剂是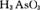 B.还原性:
B.还原性: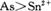
C.M为OH- D.每生成7.5 g As,还原剂失去的电子为0.3 mol
[解析]根据物质所含元素的化合价变化可知,在反应中还原剂为Sn2+, 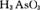 是氧化剂,还原性:Sn2+>As,故A、B不正确;由质量守恒定律可知M为H2O,故C不正确。
是氧化剂,还原性:Sn2+>As,故A、B不正确;由质量守恒定律可知M为H2O,故C不正确。
[答案]D
12.(2007·广东)氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
[解析]由方程式知:如NH3过量则会与产物HCl反应生成NH4Cl,故A正确; Cl的化合价由0→ -1,故B对;N由-3 → 0,失去的电子总数为2×3 = 6,故D正确。
[答案]C
11.下列各组物质中,每种物质都既能被氧化又能被还原的是( )
A.FeCl2、Cl2、CuSO4 B.H3PO4、HNO2、H2SO4
C.H2S、HCl、H2SO3 D.Na2S、NaClO、NH4HCO3
[解析]元素的化合价处于中间价态就既能被氧化又能被还原。
[答案]C
10.(2007·江苏)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3
 3HNCO;
8HNCO+6NO2
3HNCO;
8HNCO+6NO2  7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 molNO2在反应中转移的电子为4mol D.反应中NO2是还原剂
[解析] C3N3(OH)3
 3HNCO为化学变化,经过反应生成了不同的物质,故A不正确;8HNCO+6NO2
3HNCO为化学变化,经过反应生成了不同的物质,故A不正确;8HNCO+6NO2
 7N2+8CO2+4H2O中HNCO作还原剂,NO2作氧化剂,故B、D不正确。
7N2+8CO2+4H2O中HNCO作还原剂,NO2作氧化剂,故B、D不正确。
[答案]C
基础提升训练
9.往X溶液中通入过量的Cl2,再滴加Ba(NO3)2和稀HNO3溶液,溶液中析出白色沉淀,X盐可能是( )
A.Na2SO3 B.CaCl2 C.AgNO3 D.Na2CO3
[解析]由题意知,白色沉淀应为AgCl或BaSO4,故答案为AC。选A是因为Na2SO3被Cl2氧化成了Na2SO4
[答案]AC
8.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
[解析]化学方程式5NH4NO3=2HNO3+4N2+9H2O中,8个N原子(4N2)有5个来自NH4NO3的NH4+,有3个来自NH4NO3的NO3-,也即被氧化的氮为5个,被还原的氮为3个
[答案]A
7.吸进人体内的O2有2%转化为氧化性极强的活性氧副产物,如 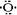 等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是( )
等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是( )
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.以上均不是
[解析]由题意知,活性氧有强氧化性,故消除活性氧应加入还原剂。
[答案]B
6.某溶液中有Fe2+、Cl-和I-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
[解析]分析各选项知,D中HCl无氧化性;A中的Cl2和B中KMnO4能氧化Fe2+和I-。
[答案]C
5.氢化钙可以作为生氢剂(CaH2中氢元素为-1价),反应方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是( )
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
[解析]该反应的本质是CaH2中的H-和H2O电离出来的H+结合生成H2,故反应中水作氧化剂。
[答案]B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com