
2.离子方程式:用实际参加反应的离子符号表示化学反应的式子。
1.离子反应:指在溶液中(或熔化状态下)有离子参加或离子生成的反应。
2.强电解质、弱电解质
|
|
强电解质 |
弱电解质 |
|
定义 |
在水溶液中能全部电离的电解质 |
在水溶液中只能部分电离的电解质 |
|
电离程度 |
完全 |
部分 |
|
电离平衡 |
不存在 |
存在 |
|
溶液中存在微粒种类 |
水合离子、水分子 |
水合离子、水分子 弱电解质分子 |
|
电离过程 |
不可逆、不存在电离平衡 |
可逆、存在电离平衡 |
|
相互关系 |
均为电解质。在相同条件下,强电解质溶液的导电能力强于弱电解质溶液 |
|
|
电离方程式 书写规律 |
用等号 HnA=nH++An- |
用可逆符号,弱酸分步电离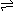 HnA
H+ +HA(n-1)- HnA
H+ +HA(n-1)-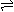 HA(n-1)- H+ +H2A(n-2)- HA(n-1)- H+ +H2A(n-2)- |
|
举例 |
强酸:HCl
H2SO4 HNO3 HClO4 HBr HI 强碱:KOH NaOH Ba(OH)2等. 绝大部分盐:BaSO4 BaCl2. 等 |
弱酸:CH3COOH HCN H2S H2CO3等 弱碱:NH3H2O Cu(OH)2等. H2O及小部分盐:(CH3COO)2Pb等. |
[例1]下列物质属于电解质的是( )
A.Na2O B.SO3 C.Cu D.NaCl溶液
[解析] Na2O为离子化合物,在熔融条件下能导电,为电解质,故A正确;SO3为共价化合物,在熔融条件下不能导电,其水溶液能导电是SO3与水反应生成的H2SO4导电,故SO3为非电解质,B不正确;Cu是单质,NaCl溶液为混合物,它们既不是电解质,也不是非电解质,故C、D都不正确。
[答案]A
|
特别提醒: 1.电解质是指在水溶液中或熔融状态下能够导电的化合物。水溶液中或熔融状态下,这两者之间只需满足一者就行了,但必须强调的是其本身能够导电,而不是反应的生成物。如SO2、SO3的水溶液虽然能导电,但它们都不是电解质,原因是在溶液中真正起到导电作用的是它们与水反应的生成物H2SO3、H2SO4,而不是它们自己本身。Na2O的水溶液的导电虽然也是它与水反应生成的NaOH导电,但因为其在熔融状态下本身能够导电,所以Na2O是电解质。 2.电解质和非电解质都是化合物,单质它既不是电解质,也不是非电解质。 3.判断某电解质是强电解质还是弱电解质关键是看它在水溶液中电离时是完全电离还是部分电离,与其溶解度大小、导电能力强弱等因素无关。 |
考点二 离子方程式的书写
第6讲 离子反应和离子方程式
★考情直播
考纲解读
|
考纲内容 |
能力要求 |
考向定位 |
|
了解电解质概念,了解强电解质和弱电解质的概念;了解电解质在水溶液中的电离,以及电解质溶液的导电性。 |
能正确判断电解质、非电解质、强电解质、弱电解质;能正确书写电离方程式;正确判断电解质溶液的导电能力强弱。 |
离子方程式的书写及正误判断、溶液中的离子共存都是高考的热点,属于每年高考必考的内容。在高考试题中,既可以以选择、填空的形式独立命题,直接考查离子方程式的书写、溶液中的离子共存,也可以穿插到推断题、实验题之中,以社会生活中的热点问题为切入点,以新知识介绍为载体,考查学生对离子反应、离子方程式的掌握程度,考查学生用离子反应、离子方程式的知识去分析、解释、处理新问题的能力。在复习中,要注意通过对比、归纳的方法,熟练掌握相应的知识规律,要注意提高运用知识分析处理新情景下问题的能力。 |
|
了解离子反应及其发生的条件,正确书写离子方程式。 |
理解离子反应的本质;能正确书写离子方程式,分析离子共存的先决条件,正确判断溶液中的离子共存。 |
考点整合
考点一 电解质、非电解质、强电解质、弱电解质
1.电解质、非电解质
|
|
电解质 |
非电解质 |
|
定义 |
在水溶液中或熔融状态下 能导电的化合物 |
在水溶液中和熔融状态下 均不能导电的化合物 |
|
本质 |
在水溶液中或熔融状态下 能够电离的化合物 |
在水溶液中和熔融状态下 均不能发生电离的化合物 |
|
导电实质 |
产生了自由移动的离子 |
没有产生自由移动的离子 |
|
结构特点 |
离子化合物和某些具有极性键 的共价化合物 |
某些共价化合物 |
|
共同点 |
均为化合物 |
|
|
注意点 |
电解质非、电解质的区分与化合物的水溶性无关. |
|
|
举例 |
NaCl
Ba(OH)2 CH3COOH |
CH3CH2OH C12H22O11 |
20.(2005·广东)化合物KxFe(C2O4)y·zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3mol/LH2SO4和适量的蒸馏水,加热到75℃,趁热加入0.0500mol/L KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL 0.0500mol/L KMnO4溶液完全反应。通过计算,分别求:
(1)0.491g样品中结晶水的物质的量。
(2)化合物中草酸根的质量分数。
(3)化合物的化学式。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
[解析](1)n(H2O) = (0.491g-0.437g)/18g·mol-1 = 0.00300mol
(2)n(C2O42-) = 0.0500mol·L-1×0.024L×5/2 = 0.00300mol
m(C2O42-) = 0.00300mol×88g·mol-1 = 0.264g
w(C2O42-) = 0.264g/0.491g ×100% = 53.8%
(3)因为n (Fe3+) = n(Fe2+) = 0.0500 mol·L-1×0.004L×5 = 0.00100mol
故有:1 : y : z = 0.00100mol : 0.00300mol : 0.00300mol = 1 : 3 : 3
则:Y = 3 , z = 3
根据电荷守恒有:x+3 = 2y, 得 x = 3
所以,化合物的化学式为:K3Fe(C2O4)2·3H2O
[答案](1)0.00300mol (2)53.8% (3)K3Fe(C2O4)2·3H2O
19.(2007·东莞)(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:

反应中___________ 元素被还原。
(2)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)类似,化学上称为拟卤素。[如:(SCN)2+H2O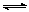 HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:
HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:
①(CN)2与KOH溶液反应的化学方程式;
②NaBr与KSCN的混合物中加入(CN)2的离子方程式。
[解析](1)为氧化还原反应配平题。此题重点在于找准F、Mn、Sb元素的化合价,关键是F的价态。F在化合物中一定为-1价,由此确定K2MnF6中Mn为+4价,反应后在MnF3中为+3价。SbF5中Sb为+5价,而在KSbF6中Sb为+5价。然后用化合价升降法配平即可。
(2)为信息题,解题抓住两条信息,一是(CN)2、(SCN)2与X2很相似,解题时看成Cl2;二是阴离子还原顺序为Cl-<Br-<CN-<SCN-<I-。由此可得②小题答案,即(CN)2只能氧化SCN-而不能氧化Br-。
[答案](1)2 4 4 2 1 锰
(2)①(CN)2+2KOH===KCNO+KCN+H2O;②2SCN-+(CN)2===(SCN)2+2CN-
18.(2007·全国)已知氧气还原反应:2Cu(IO3)2 + 24KI+12 H2SO4 = 2CuI +13I2+12K2SO4+12H2O其中1mol氧化剂在反应中得到的电子为( )
A.10 mol B.11 mol C.12 mol D.13 mol
[解析]题中Cu(IO3)2 为氧化剂,Cu(IO3)2中铜由+2→+1,碘由+5→0,合计每摩尔Cu(IO3)2得到11 mol电子。
[答案]B
17.(2006·江苏)物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质由于浓度不同而能发生不同氧化还原反应的是( )
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
A.①③ B.③④ C.①② D.①③④
[解析]①中Cu与HNO3反应,因HNO3的浓稀不同,产物有NO2和NO两种情况;③中Zn与H2SO4反应,因H2SO4的浓稀不同,产物有SO2和H2两种情况。
[答案]A
16.(2007·上海)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O ;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
[解析](1)从KMnO4、Na2CO3、Cu2O、Fe2(SO4)3来看,只有Cu2O才有还原性。
(2)硝酸在反应中既作了氧化剂,又生成了硝酸盐,所以硝酸表现出了氧化性和酸性。
(3)由方程式14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O知,产生0.2mol气体转移的电子的物质的量是0.6mol。
(4)用了较浓的硝酸,产物中有部分二氧化氮生成,从而被还原硝酸的物质的量增加。
[答案](1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O;(2)酸性,氧化性;(3)0.6mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
能力提高训练
15.(2007·广州省实)单质铁溶于一定浓度的硝酸中反应的化学方程式如下:
a Fe+b NO3-+c H+==d Fe2++f Fe3++g NO↑+h N2O↑+k H2O(化学计量数均为正整数)
请你用已掌握的知识研究出下列规律。
(1) c、g、h的关系式是____________________。
(2) b、c、d、f的关系式是_________________________。
(3) d、f、g、h的关系式是_________________。
(4)若a =12,铁和硝酸恰好完全反应,则b的取值范围是________________。c的取值范围是______________________。
[解析](1)元素守恒:c=2k 3b=g+h+k 即:6b=2g+2h+c 又:b=g+2h 故:c = 4g+10h
(2)电荷守恒:c=2d+3f+b 即:c-b=2d+3f
(3)电子转移守恒;3g+8h=2d+3f
(4)当Fe→ Fe2+ ,NO3-→N2O时,b有最小值。b=12×2/4 = 6
当Fe→Fe3+,NO3-→NO时,b有最大值。b=12×3/3 = 12 故有:6<b<12
把6<b<12代入c=2d+3f+b(c=2d+b;c=3f+b)得:30<c<48
[答案](1) c = 4g+10h (2) c-b=2d +3f (3) 2d +3f =3g+8h (4) 6<b<12 30<c<48
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com