
7.(2007·广东)某溶液中可能含有SO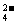 、CO
、CO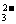 、Cl-。为了检验其中是否含有SO
、Cl-。为了检验其中是否含有SO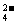 ,除BaCl2,除BaCl2溶液外,还需要的溶液是( )
,除BaCl2,除BaCl2溶液外,还需要的溶液是( )
A.H2SO4 B.HCl C.NaOH D.NaNO3
[解析]题中除了SO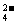 与 Ba2+产生白色沉淀外,CO
与 Ba2+产生白色沉淀外,CO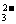 与 Ba2+也会产生白色沉淀。但Ba
SO4不溶于盐酸,而BaCO3则易溶。
与 Ba2+也会产生白色沉淀。但Ba
SO4不溶于盐酸,而BaCO3则易溶。
[答案]B
6.(2007·江苏)向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离于组是( )
A.K+、Br-、CO32- B.Al3+、H+、MnO4- C.NH4+、Fe3+、SO42- D.Ag+、Cu2+、NO3-
[解析]通入足量NH3后,溶液呈碱性。选项B中H+,C中Fe3+,D中Ag+、Cu2+都不可大量存在。
[答案]A
5.某无色溶液加入氯化钡溶液后有白色沉淀,再加稀硝酸沉淀不消失,则该溶液中( )
A.一定含有SO42- B.一定含有Ag+
C.至少含有SO42-或SO32-或Ag+ D.可能含有Ag+ 和SO42-
[解析]要注意SO32-的干扰。
[答案]C
4.对下列反应①NaHCO,溶液与石灰水反应、②KAlO2溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是( )
A.①②③ B.①②④ C.①③④ D.②③④
[解析]①NaHCO3溶液与石灰水反应,
如NaHCO3不足,离子方程式为:HCO3-+Ca2++OH-=CaCO3↓+H2O
NaHCO3过量,离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+ CO32-
②KAlO2溶液与稀盐酸反应,
如KAlO2不足,离子方程式为:AlO2-+ 4H+=Al3++2H2O
KAlO2过量,离子方程式为:AlO2-+ H++H2O =Al(OH)3↓
④Fe与稀硝酸反应,
如Fe不足,离子方程式为:Fe+ NO3-+4H+= Fe 3++NO↑+2H2O
Fe过量,离子方程式为:3Fe+ 2NO3-+8H+= 3Fe 2++2NO↑+4H2O
[答案]B
3.(2007·广东理基)下列反应的离子方程式正确的是( )
A.向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-==2H2O+BaCl2
B.往FeCl3溶液中加入Fe粉:2Fe3++Fe ==3Fe2+
C.往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2==CaCO3↓+H2O
D.往FeCl3溶液中加入Cu粉:Fe3++Cu==Fe2++Cu2+
[解析]氯化钡是可溶性盐,故A的离子方程式为:H++OH-=H2O;C中生成的CaCO3能与过量的二氧化碳在溶液中继续反应,故往澄清石灰水中通入过量二氧化碳的离子方程式为:OH-+CO2== H CO3-;D中铁元素的化合价降低1,铜元素的化合价升高2,故往FeCl3溶液中加入Cu粉的离子方程式为:2Fe3++Cu=2Fe2++Cu2+。
[答案]B
2.(2007·广东)下列化学反应的离子方程式正确的是( )
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
[解析]B中的碳酸镁为难溶物,要写成化学式;C中的氨水要写成分子式,且产物为Al(OH)3 ;D的离子方程式应为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O
[答案]A
1.用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是( )
A.白醋中滴入石蕊试液呈红色 B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示白醋的pH为2-3
[解析]要证明某物质是强电解质还是弱电解质,关键是看该物质在溶液中是完全电离,还是部分电离。如完全电离,则为强电解质,如部分电离,则为弱电解质。浓度约1 mol/L的醋酸其pH为2-3,说明醋酸在溶液中是部分电离的,故为弱电解质。
[答案]D
2.附加隐含条件的应用规律:
⑴溶液无色透明时,则溶液中一定没有有色离子,如Cu2+、Fe3+、Fe2+、MnO4-
⑵强碱性溶液中肯定不存在与OH-反应的离子,如Fe3+、 Fe2+、HCO3-、NH4+、Al3+
⑶强酸性溶液中肯定不存在与H+反应的离子,如HCO3-、CO32-、S2-、CH3COO-、AlO2-
[例3](2008·全国理综)在溶液中加入少量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
[解析]由题意知,往溶液中加入少量Na2O2后,①Na2O2会与原溶液中的水反应生成NaOH,使溶液呈碱性,故NH4+、Mg2+、HCO3-不能与其大量共存,A、C不正确;②Na2O2有强氧化性,会氧化溶液中的一些还原性离子,如Fe2+、SO32-等,故D不正确。
[答案]B
★真题回放
热点一 电解质的强弱、电解质溶液的导电能力强弱判断
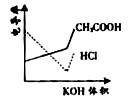 [真题1](2008·广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
[真题1](2008·广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
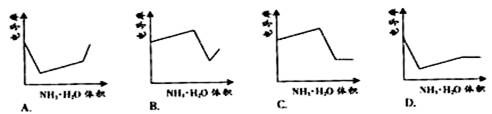
[解题思路]电解质溶液的导电能力只与溶液中自由移动的阴阳离子的浓度有关,溶液中自由移动的阴阳离子的浓度越大,溶液的导电能力越强。解答时要注意溶液中反应前后自由移动的离子的浓度变化。
[解析]把NH3·H2O溶液滴加到HCl和CH3COOH混合溶液的过程中,开始时,滴入的NH3·H2O先跟HCl反应,生成NH4Cl和H2O,反应前后溶液中自由移动的离子的数目几乎没变,但溶液的体积增大了,自由移动的离子浓度降低,溶液的导电能力减弱;当HCl反应完全后,则滴入的NH3·H2O就会和CH3COOH反应,生成强电解质CH3COONH4,从而增强了溶液的导电能力;当CH3COOH反应完全后,继续滴加NH3·H2O,溶液中自由移动的离子浓度不再变化,溶液的导电能力也就无明显变化。
[答案]D
名师指引
电解质溶液的导电能力强弱主要是与溶液中自由移动的阴阳离子的浓度大小有关,一般来说,溶液中自由移动的阴阳离子的浓度越大,则溶液的导电能力越强;反之,则弱;与电解质本身的强弱无关。
新课导学1
1-1.(2007·北京东城)甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1摩/升甲酸溶液的pH值约为2
B.甲酸能与水以任何比例互溶
C.10毫升1摩/升甲酸恰好与10毫升1摩/升NaOH溶液完全反应
D.在相同条件下,甲酸溶液的导电性比盐酸溶液的弱
[解析]判断电解质强弱的依据是电解质自身电离程度的大小,而不是溶液导电能力的强弱。若甲酸是强电解质,则1摩/升甲酸溶液的pH值应为0,而选项中1摩/升甲酸溶液的pH值约为2,说明在溶液中甲酸是部分电离的,故A正确;酸的溶解性,酸与碱发生中和反应的情况与酸的强、弱没有必然的联系,故B、C不正确;在相同条件下,盐酸中HCl全部电离,溶液中自由移动的离子浓度大,导电能力强,故D正确。
[答案]A D
1-2.(2007·北京海淀)把各组中的气体通入溶液中,溶液导电能力显著增强的是 ( )
A.CO2通入NaOH溶液 B.CO2通入石灰水
C.NH3通入CH3COOH溶液 D.NH3通入盐酸溶液中
[解析]溶液的导电能力与溶液中自由移动的离子的浓度成正比。由于CH3COOH是弱酸,其电离程度小,溶液中的离子浓度较小,相同条件下,导电能力弱于强电解质,当通入NH3后,生成了强电解质CH3COONH4,导电能力就会显著增强。
[答案]C
热点二 离子方程式的正误判断
[真题2](2008·广东)下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量的CO2:NH3·H2O + CO2 == NH4+ + HCO3-
B.少量的SO2通入溶液Ca(ClO)2中:SO2 + H2O + Ca2+ + 2ClO- == CaSO3↓+ 2HClO
C.用稀HNO3溶解FeS固体:FeS + 2H+ == Fe2+ + H2S↑
D.氢氧化钙与等物质的量的稀硫酸混合:Ca2+ + OH+ + H+ + SO42- == CaSO4↓+ H2O
[解题思路]根据离子方程式的书写规则来正确书写即可,但书写时要注意题给中的“溶液显中性”“某某物质过量”等特殊条件。
[解析]B中Ca(ClO)2有强氧化性,会把+4价的S氧化为+6价,从而得到CaSO4↓,故B不正确;C中稀HNO3有强氧化性,会氧化FeS,故C不正确 ;D的离子方程式应为:Ca2+ + 2OH+ + 2H+ + SO42- == CaSO4↓+ 2H2O,故D不正确。
[答案]A
名师指引 与量有关的离子方程式的书写:
与量有关的离子方程式的书写是离子方程式书写的难点,也是高考的热点。认真分析题给中各反应物的量,熟悉一些常见的与量有关的离子方程式是突破该难点的保证。
(1)对于复分解反应,按“以少定多”的原则来书写,即以量少的反应物(离子)确定量多离子前面的系数。如:
① 向NaHCO3溶液中滴加少量的Ba(OH)2溶液
② 向NaOH溶液中滴加过量Ca(HCO3)2溶液
[解析](1)可知参加反应的离子为HCO3-、Ba2+、OH -,因Ba(OH)2少量,可知其中的离子Ba2+ 、 OH -应完全反应。我们可假设其少到极限,只有“1分子”的Ba(OH)2 ,即1个Ba2+ 、2个 OH-。2个OH-离子可与2个HCO3-反应生成2个H2O分子和2个CO32-, 而2个CO32- 有1个与Ba2+ 结合转化为BaCO3 沉淀,剩余1个留在溶液中。
故其离子方程式为:Ba2+ +2OH- +2HCO3- = BaCO3 ↓+CO32- +2H2O
同理,(2)的离子方程式为:OH - + HCO3- + Ca2+ = CaCO3↓+H2O
(2)对于氧化还原反应,按“强先弱后”的原则来书写,即氧化性(或还原性)强的优先发生反应,氧化性(或还原性)弱的后发生反应。如:
请写出向FeBr2溶液中通入少量Cl2的离子方程式。
[解析]在FeBr2溶液中Fe2+和Br-均有还原性,但还原性Fe2+大于Br-,故通入少量的Cl2时,Fe2+先被氧化,所以正确的离子方程式为:2Fe2++Cl2 = 2Fe3++2Cl-
另外,对于某些特殊反应,如向苯酚钠溶液中不论通入“过量”还是“少量”的CO2均生成苯酚沉淀和NaHCO3。
新课导学2
2-2.(2008·江苏)下列反应的离子方程式书写正确的是( )
A.硫酸铝溶液中加入过量氨水Al3++30H-══Al(OH)3↓
B.电解饱和食盐水
C.碳酸钙与盐酸反应CaCO3+2H+═Ca2++CO2↑+H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2══Fe3++2H2O
[解析]A中氨水应写成分子式;D中电荷不守恒;离子方程式书写正确的是B C
[答案]BC
2-3.(2008·重庆)能正确表示下列化学反应的离子方程式是( )
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2 +H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:A1+2H+=A13++H2 ↑
C.硫化钠溶于水中:S2-+2H2O=H2S↑+ 2OH-
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
[解析]B中电荷不守恒;C中硫离子水解应分两步进行;D中碳酸镁为不溶物。
[答案]A
热点三 溶液中的离子共存
[真题3](2008·山东)在给定的四种溶液中,加入以下各种离子,能在原溶液中较大量共存的是( )
A.pH为1的溶液:Cu2+、Na+、Mg2+、NO3-
B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN-
C.所含溶质为Na2S2O3的溶液:K+、SO42-、NO3-、OH-
D.水电离出来的c(H+)=1×10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
[解题思路]根据离子反应发生的条件来判断溶液中的离子共存,要注意题给中的附加隐含条件。
[解析]由于Fe3+ 与SCN-生成[Fe(SCN)2+,故B中的离子不能共存;当水电离出来的c(H+)=1×10-13mol/L时,溶液呈强酸性或强碱性,而HCO3-在上述两种情况下均不能存在,故D中的离子也不能存在。
[答案]AC
名师指引
溶液中的离子共存,是个细活计,所涉及的知识多且广,特别要求要能熟练掌握一些边缘零碎知识。如Fe2+在酸性条件下不与NO3- 共存, HCO3-与 AlO2-不能大量共存,Ca2+与F-不能大量共存,Fe3+与SCN-不能大量共存,H+ 、OH- 与HPO42- 、H2PO4-不能大量共存等等,同时在答题时要注意题目中的一些附加的、隐含的条件。
新课导学3
3-1.(2008·江西彭泽二模)下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Cl-、NO3-、MnO4-
②pH=11的溶液中:CO32-、Na+、S2-、SO32-
③水电离的c(H+)=1×10-13mol/L的溶液中:Cl-、HCO3-、NH4+、S2O32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、K+、Cl-
⑤酸性溶液中:Fe2+、NO3-、I-、Al3+
A.①② B.③⑤ C.②④ D.④⑤
[解析]无色溶液中不含有色的MnO4-,①不正确;水电离的c(H+)=1×10-13mol/L的溶液既可能酸性溶液也可能是碱性溶液,HCO3-肯定不能存在,③不正确;在酸性条件下,NO3-能氧化Fe2+、I-,⑤不正确。
[答案]C
3-2.(2008·江西师大附中、鹰潭一中联考)一定能在指定环境中大量共存的是( )
A.c(H+)=1×10-2mol·L-1的溶液:Na+、NH4+、CO32-、SO42-
B.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe3+ ClO- Na+ SO42-
C.在pH=1的溶液中:NO3- SO42- Na+ Fe2+
D.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
[解析] c(H+)=1×10-13mol/L的溶液为酸性溶液, CO32-不可以大量存在,故A不正确;由水电离出的c(H+)=1×10-12mol/L的溶液既可能酸性溶液也可能是碱性溶液,如为酸性溶液,ClO-不可以大量存在,如是碱性溶液,则Fe3+ 不可以大量存在,故B不正确;pH=1的溶液为酸性溶液,在酸性条件下,NO3-能氧化Fe2+,故C不正确。
[答案]D
★抢分频道
限时基础训练
1.离子共存条件:
同一溶液中若离子间符合下列任意一个条件就会发生离子反应,它们之间便不能在溶液中大量共存。
⑴生成难溶物或微溶物:如:Ba2+与CO32-,Ag+与Br-,Ca2+与SO42-等不能大量共存。
⑵生成气体或挥发性物质:如:NH4+与OH-,H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等不能大量共存。
⑶生成难电离物质:如:H+与CH3COO-、CO32-、S2-、SO32-等因生成弱酸不能大量共存;OH-与NH4+因生成的弱碱不能大量共存;H+与OH-生成水不能大量共存。
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-(H+)等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
3.离子方程式的书写:
(1)书写规则:
①单质、氧化物、不溶物、难电离的物质(弱酸、弱碱及水等)不能拆开来写。如Cl2、Na2O等不可以拆开写成Cl-、Na+、O2-;BaSO4不可以拆开写成Ba2+、SO42-形式。
②易溶于水,易电离的物质的离子符号的改写同电离方程式中的离子形式。如NaHCO3改写Na+、HCO3-;NaHSO4应改写Na+,H+,SO42-
③微溶物,若出现在反应物中一般改写成离子符号(悬浊液除外);若出现在生成物中一般不改写。
④固体与固体物质反应不写离子方程式。如实验室制取NH3的离子方程式为:
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
⑤浓H2SO4、浓H3PO4一般不拆开写成离子形式;HCl、HNO3无论浓稀,均应改写成离子符号。如Cu片与浓H2SO4反应的离子方程式为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
(2)书写步骤(以CuSO4溶液与BaCl2 溶液反应为)
①写出反应的化学方程式:CuSO4+BaCl2==CuCl2+BaSO4↓
②把易溶于水、易电离的物质拆开写成离子形式,难溶的物质或难电离的物质以及气体等仍用化学式来表示。上述化学方程式可改写成:
Cu2++SO42-+Ba2+ +2Cl- =Cu2++2Cl-+BaSO4↓
③删去方程式两边不参加反应的离子符号:Ba2+ + SO42- =BaSO4↓
④检查离子方程式两边各元素的原子个数和电荷总数是否相等。
|
特别提醒: 常见离子方程式的书写错误 (1)不配平(一般表现为等式两边原子不守恒或电荷数不守恒)。如Fe3++Cu =Cu2++Fe2+; Na+H2O=Na++OH-+H2↑ (2)该改的不改或不该改的改了。如Na2O溶于水:O2- + H2O = 2OH-;大理石和稀盐酸反应:CO32-+2H+=CO2↑+H2O;醋酸铵溶液与烧碱溶液共热:CH3COONH4+OH- =CH3COO-+ NH3↑+H2O;乙醛做银镜反应:CH3CHO+2[Ag(NH3)2]OH→CH3COO-+NH4++2Ag↓+3NH3+H2O等等…… (3)与反应事实不相符合。如铁片溶于稀HCl:2Fe+6H+ =2Fe3++ 3H2↑;铝条溶于稀HNO3:2Al+6H+ = 2Al3++3H2↑ (4)不是离子反应的写离子方程式。离子反应发生在水溶液中或熔融状态下,否则就不能写离子方程式。如浓硫酸与食盐共热制HCl;浓硫酸与Cu共热制SO2;实验室制CH4和NH3等都无离子方程式。   (5)乱用↑、↓、 、 符号。如FeCl3溶液的水解:Fe3+
+ 3H2O = Fe(OH)3↓+ 3H+;F2通入水中:2F2+2H2O=4HF+O2↑;Na2CO3的水解:CO32-+H2O=HCO3-+OH- (5)乱用↑、↓、 、 符号。如FeCl3溶液的水解:Fe3+
+ 3H2O = Fe(OH)3↓+ 3H+;F2通入水中:2F2+2H2O=4HF+O2↑;Na2CO3的水解:CO32-+H2O=HCO3-+OH-(6)多步水解或电离的方程式一步完成或水解与电离方程式分不清楚。如Na2S溶于水:S2-+2H2O H2S +2OH- ;H2S溶于水:H2S 2H+ + S2-。   (7)漏写一种产物。如CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓;Ba(OH)2溶液中滴加稀H2SO4:H+ +
OH- = H2O。 (7)漏写一种产物。如CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓;Ba(OH)2溶液中滴加稀H2SO4:H+ +
OH- = H2O。(8)随便约简或不约简。如Ba(OH)2溶液不断滴加稀H2SO4:Ba2++H++OH-+SO42-=BaSO4↓+ H2O;Al2(SO4)3溶液中加氨水:2Al3+ +6NH3·H2O=2Al(OH)3↓+6NH4+ |
[例2](2008·上海)下列离子方程式书写正确的是( )
A.AgNO3溶液中滴入少量的Na2S溶液 2Ag+ + S2-==Ag2S↓
B.过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O==HCO3-+HClO
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+==CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-==BaSO3↓+SO32-+2H2O
[解析]CH3COOH为弱电解质,不可拆开写成离子形式,故C不正确;因加入的NaHSO3溶液少量,则在反应中Ba(OH)2过量,书写离子方程式时应以少量的NaHSO3为主,其离子方程式应为:HSO3-+Ba2++OH-==BaSO3↓+ H2O,故D不正确。
[答案]A B
考点三 溶液中的离子共存
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com