
17.(2008·全国)下列离子方程式书写正确的是( )
A.向NaHSO4溶液中滴加Ba(OH)2溶液显中性:H++SO42-+Ba2++OH-==BaSO4↓+H2O
B.向NaAlO2溶液中加盐酸至呈酸性:AlO2-+4H+==Al3++2H2O
C.碳酸氢铵溶液中加入过量NaOH:HCO3-+OH-==CO32-+H2O
 D.向苯酚钠溶液中通入过量CO2:2
D.向苯酚钠溶液中通入过量CO2:2 -O-+CO2+H2O → 2 -OH+CO32-
-O-+CO2+H2O → 2 -OH+CO32-
[解析]为了方便,可假设NaHSO4为1mol,要使NaHSO4溶液显中性,则滴加Ba(OH)2应为1/2 mol,其离子方程式应为:2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O ,故A不正确;C中漏写了NH4+与OH-的反应,故C不正确;D中的产物应为HCO3-。
[答案]B
16. (2008江西金太阳第6次全国大联考)有一瓶澄清溶液,其中可能含有K+、Na+、Mg+、Al3+、Cl-、AlO2-、I-、OH-中的几种,取该溶液进行如下实验;
①用pH试纸检测,溶液星强碱性,焰色反应透过蓝色钴玻璃观察到紫色火焰。
②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡、静置后,CCl4层呈紫红色。
③另取部分溶液,逐滴加人稀HCl溶液,使溶液从碱性逐渐变为酸性,在漓加过程中溶液出现沉淀;滴加完毕后,溶液中沉淀消失。
根据上述实验事实入完成下列问题:
(1)该溶液中肯定存在的离子有____ ___ 。
(2)该溶液中肯定不存在的离子有___ ____ 。
(3)该溶液中还不能确定是否存在的离子有___ ____。
[解析]根据题意,由①知,有K+、OH–,无Mg2+ Al3+;由②知,有I-;由③知,有AlO2-;Na+、Cl-无法确定。
[答案](1)K+、I-、AlO2-、OH - (2)Mg2+ Al3+ (3)Na+、Cl-
能力提高训练
15.A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+
Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- CO32- HSO-4 |
分别取它们的水溶液进行实验。结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。据此推断它们是:A ;B ;C ;D ;E ;
[答案]A: Na2CO3 B: Al2(SO4)3 C: MgCl2 D: Ba(OH)2 E: NaHSO4(或Mg(HSO4)2)
14.(2008·深圳高三调研)M和N两溶液分别含有下列十二种离子中的五种和七种离子:K+、Na+、H+、NH4+、Fe3+、A13+、Cl―、OH―、NO3―、S2―、CO32―、SO42―。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是( )
A.OH―、CO32―、SO42― B.S2―、Cl―、SO42―
C.CO32―、NO3―、S2― D.Cl―、SO42―、NO3―
[解析]以H+、OH-为基准,根据溶液中的离子共存情形,把题给中的12种离子分成中的两组,M组中一定有:OH―、S2―、CO32―,N组一定有:H+、NH4+、Fe3+、A13+ 。
[答案]D
13.(2008·江西金太阳第7次全国大联考)下列反应对应的离子方程式正确的是( )
A.铜与硝酸银溶液反应:
B.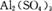 溶液中加入过量氨水:
溶液中加入过量氨水:
C.氢氧化钡溶液和稀硫酸反应: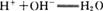
D.用惰性电极电解CuCl2溶液: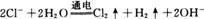
[解析]A中没有配平,电荷不守恒;C中有BaSO4沉淀生成;D中阴极析出的是单质Cu,产物不正确。
[答案]B
12.(2007·上海)下列反应的离子方程式正确的是( )
A.氢氧化钠溶液中通入少量二氧化硫:SO2+OH- = HSO3-
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3- +Ba2++OH- = BaCO3↓+H2O
C.盐酸滴入氨水中:H-+OH- = H2O
D.碳酸钙溶解于稀硝酸中:CO32 -+2H+ = CO2↑+H2O
[解析]A项当二氧化硫为少量时,在溶液中生成的应该是SO32-;C项中氨水为弱碱,应用NH3·H2O表示;D项碳酸钙为难溶于水的物质,应用CaCO3表示。
[答案]B
11.(2008·惠州一中)限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐在溶液中反应,符合离子方程式2H++SO32- = H2O+SO2↑的化学方程式个数有( )
A.3 B.5 C.8 D.12
[解析]符合题意的离子方程式有:稀硫酸、盐酸、硫酸氢钠、硫酸氢钾分别与亚硫酸钠、亚硫酸钾反应。
[答案]C
10.(2007·上海)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
[解析]由(1)知溶液中可能有Cl-、CO32-、SO42-;由(2)知溶液中一定NH4+;由(3)知溶液一定有SO42-和CO32-,无Ba2+ 、Mg2+,有K+。再由(3)中数据可算出:
nSO42-=2.33/233=0.01mol , nCO32-=(6.27-2.33)/197=0.02mol
[答案]A C
基础提升训练
9.(2008·惠州二模)要使含有Ag+、Cu2+、Mg2+、Ba2+等离子的溶液中的离子逐一形成沉淀析出,下列所选择试剂及加入试剂的顺序正确的是( )
A.H2SO4→HCl→K2S→NaOH→CO2 B.Na2SO4→NaCl→Na2S→NH3·H2O
C.NaCl→Na2SO4→H2S→NaOH D.Na2S→Na2SO4→NaCl→NaOH
[解析]要使溶液中的离子逐一形成沉淀析出,则每加入一种试剂都对应除去一种离子,所加的试剂不能使其他离子形成沉淀。
[答案]C
8.(2008·江西省信丰中学)常温时,某溶液中由水电离出的H+和OH-的物质的量浓度乘积为1×10-26,该溶液中一定能大量存在的离子组是( ) A.K+、Ba2+、Cl-、NO3- B.Fe3+、Cu2+、Cl-、HCO3- C.K+、Na+、SO32-、SO42- D.Ca2+、Al3+、H+、NO3- [解析]由题给中“由水电离出的H+和OH-的物质的量浓度乘积为1×10-26”可知,水的电离被抑制了,该溶液可能为酸性,也可能为碱性。故B中的HCO3-一定不能大量存在,Fe3+、Cu2+不一定能大量存在,C中的SO32-不一定能大量存在,D中的Al3+、H+ 不一定能大量存在。
[答案]A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com