
3.溶质质量分数(a%)
溶质质量分数=
[例2](2008·南昌一模)右图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。
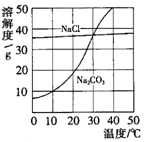 (1)当温度为10℃时,碳酸钠的溶解度为
;
(1)当温度为10℃时,碳酸钠的溶解度为
;
(2)当温度 时,氯化钠的溶解度大于碳酸钠的溶解度;
(3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。请你解释原因:“夏天晒盐” ;
“冬天捞碱” 。
[解析]由题给中的溶解度曲线易看出,10℃时,碳酸钠的溶解度为10g;30℃时,氯化钠、碳酸钠的溶解度大致相等,当温度高于30℃,氯化钠的溶解度小于碳酸钠的溶解度,当温度低于30℃时,氯化钠溶解度大于碳酸钠的溶解度;且氯化钠的溶解度随温度的变化不大,碳酸钠的溶解度随温度的变化很大,所以加热蒸发浓缩有利于氯化钠晶体的析出,降温冷却则有利于碳酸钠晶体的析出。
[答案](1)10g (2)小于30℃ (3)氯化钠的溶解度受温度影响不大,夏天温度高水分蒸发快,氯化钠易结晶析出;碳酸钠的溶解度受温度影响大,冬天温度低,碳酸钠易结晶析出。
考点三 胶体及其性质
2.气体的溶解度
在一定温度和1.01×105Pa时,1体积溶剂里达到溶解平衡时溶解的气体体积数(要换算成标准状况时的气体体积)。气体溶解度随温度的升高而减小,随压强的增大而增大。
1.固体的溶解度
(1)定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
注意点:①一定温度 ②100g溶剂 ③达到溶解平衡状态(饱和状态)④单位是克(g)
(2)有关关系式:S(溶解度)=
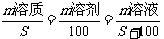

(3)溶解度曲线:
溶解度曲线是溶解度随温度变化的一种
表示方法。溶解度曲线可表示:
①同一物质在不同温度时的不同溶解度;
②不同物质在同一温度时不同溶解度;
③物质溶解度受温度变化影响的大小;
④比较不同物质的溶解度的大小。
4.溶解平衡
在一定条件下,溶解速率等于结晶速率的状态叫溶解平衡。溶解平衡是动态平衡,溶解和结晶仍在进行。达到溶解平衡的溶液是饱和溶液,它的浓度一定,未达到溶解平衡的溶液是不饱和溶液,通过加入溶质、蒸发溶剂、改变温度等方法可使不饱和溶液成为饱和溶液。
未溶解的固体溶质 溶液中的溶质
溶液中的溶质
[例1](2008·眉山市)向200C的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
A.溶液温度末冷却到200C时,溶液一定是饱和溶液
B.溶液温度末冷却到200C时,溶质质量分数比甲溶液大
C.溶液温度恢复到200C时,溶液质量比甲溶液小
D.溶液温度恢复到200C时,溶液的溶质质量分数和甲溶液的相等
[解析]Ca(OH)2的溶解度随着温度的升高而降低。向200C的饱和澄清石灰水中投入适量的氧化钙粉末,加入的CaO会与水反应生成Ca(OH)2,不仅消耗了溶剂水,并且反应会放出大量的热,使溶液的温度升高,所以当溶液的温度等于200C时,肯定会有溶质Ca(OH)2析出,所得的溶液仍为饱和溶液,溶质的质量分数不变。
[答案]B
考点二 溶解度、溶质的质量分数
3.溶解过程:溶质分散到溶剂里形成溶液的过程叫溶解。物质溶解时,同时发生两个过程:

溶解是一个物理、化学过程,并伴随着能量变化,溶解时溶液的温度是升高还是降低,取决于上述两个过程中放出和吸收热量的相对大小。如:浓硫酸稀释溶液温度升高,NH4NO3溶于水溶液温度降低。
2.溶液的组成:溶液=溶质+熔剂
 溶质:被分散的物质。如食盐水中的NaCl;氨水中的NH3;碘酒中的I2
溶质:被分散的物质。如食盐水中的NaCl;氨水中的NH3;碘酒中的I2
溶剂:溶质分散其中的物质。如食盐水、氨水中的水;碘酒中的酒精
1.溶液的概念:一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。
20.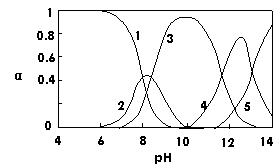 (2007·广东)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
(2007·广东)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,
4表示Pb(OH)3-,5表示Pb(OH)42-]
⑴Pb(NO3)2溶液中,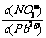 2
2
(填“>”、“=”、“<”);往该溶液中滴入
氯化铵溶液后,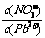 增加,可能的原因是
增加,可能的原因是
。
⑵往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有 ,pH=9时,主要反应的离子方程式为 。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 。
⑷如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+ E2Pb(s)+2H+ 则脱铅的最合适pH范围为 (填代号)。
E2Pb(s)+2H+ 则脱铅的最合适pH范围为 (填代号)。
A.4-5 B.6-7 C.9-10 D.11-12
[答案](1)由Pb2+易水解知应填 > ;Pb2+与Cl-发生反应,使C(Pb2+)减小。
(2)Pb2+ 、Pb(OH)+ 、H+ ;Pb2++2OH-=Pb(OH)2↓ (3)Fe3+ (4)A
19.(2008·江苏)下列各种环境下的离子组合中,离子不能大量共存的是( )
A.无色中性溶液:Mg2+、Fe3+、SO42-、Cl-
B.pH=0溶液:Al3+、NH4+、Mg2+、HSO4-
C.[H+]=10-10mol/L溶液:Na+、AlO2-、S2-、S2O32-
D.[H+]>[OH-]的溶液:Fe3+、ClO-、I-、NO3-
[解析]Fe3+呈黄色,不满足题意,故A不正确;D为酸性溶液,在酸性条件下,ClO-、NO3-能氧化I-,故不能共存。
[答案]A D
18.(2007·北京)在由水电离产生的H+ 浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④ Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
[解析]水电离产生的H+浓度为1×10-13mol·L-1的溶液既可能呈酸性也可能呈碱性中。①中S2-,②中Fe2+、I-,④中HCO3-都不能与H+大量共存,不合题意。
[答案]B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com