
7.(2008·厦门一模)某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度,则下列说法正确的是( )
A.沉淀的质量为5.6g B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g D.饱和石灰水的质量小于98.2g
[解析]加入的5.6g生石灰与水反应消耗水1.8g,生成Ca(OH)27.4g。反应过程中溶剂水的消耗会促使原溶液中的Ca(OH)2析出,从而使溶液的质量减少,小于100g-1.8g=98.2g,故应选D。
[答案]D
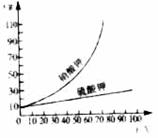
6.将KNO3和K2SO4混合物进行分离,有如下操作:
①将混合物溶解制成浓溶液;②加热蒸发浓溶液;
③冷却溶液;④过滤,移出KNO3晶体;
⑤过滤,移出K2SO4晶体。试根据图象分析,
判断出正确的操作顺序是( )
A.①②③④⑤ B.①②⑤③④
C.①③⑤②④ D.①③④②⑤
[解析]由题给中的溶解度曲线易看出,KNO3的溶解度随温度的变化较大,K2SO4的溶解度随温度的变化较小,所以加热蒸发浓缩有利于K2SO4晶体的析出,降温冷却则有利于KNO3晶体的析出。
[答案]B
5.硫酸钠的结晶水合物中含结晶水55.9%,则其化学式为( )
A.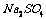 ·
·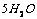 B.
B.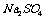 ·
·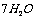 C.
C. 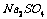 ·
·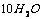 D.
D.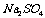 ·
·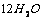
[解析]结晶水合物中含结晶水55.9% ,则含硫酸钠为44.1%,取100克该结晶水合物来计算,则有:nH2O/ nNaSO4 = 55.9×142/18 ×44.1 = 10
 [答案]C
[答案]C
4.(2008·广东茂名)向胶体中加入电解质能使胶体聚沉。使一定量的胶体溶液在一定时间内开始凝聚所需电解质的浓度(c mol/L)称作“聚沉值”,电解质的“聚沉值”越小,则表示其凝聚能力越大,实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大,则向 Fe(OH)3 胶体中加入下列电解质时,其“聚沉值”最小的为( )
A.NaCl B.FeCl3 C.K2SO4 D.Na3PO4
[解析]由题意知,因 Fe(OH)3 胶体中的胶粒带正电,则最容易使其凝聚,即“聚沉值”最小的是带有最多负电荷的阴离子。
[答案]D
3.(2007·华师一附中)不能用有关胶体的观点解释的现象是( )
A.在河流入海口易形成三角洲
B.同一钢笔同时使用不同牌号的墨水易发生堵塞
C.在NaCl溶液中滴入AgNO3溶液有沉淀
D.在实验中不慎手被玻璃划破,可用FeCl3溶液应急止血
[解析]A、B、D都属于胶体的聚沉;C是因为反应生成了AgCl沉淀。
[答案]C
2.(2007·广东理基)下列说法正确的是( )
A.可用丁达尔现象区分溶液与胶体 B.生石灰与水混合的过程只发生物理变化
C.O3是由3个氧原子构成的化合物 D.CuSO4·5H2O是一种混合物
[解析]CaO不仅能溶于水(物理变化),而且会与H2O发生化学反应,生成Ca(OH)2,B错;O3是由3个氧原子构成的单质,C错;CuSO4·5H2O是一种结晶水化合物,D错。
[答案]A
1.(2008·北京海淀)根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
[解析]日常生活中所见到的烟、云、雾都是胶体。
[答案]D
3.胶体的重要性质
①丁达尔现象:光通过胶体时所产生的光亮的通路的现象。胶体的丁达尔现象是由于胶体微粒对光线的散射而形成的,溶液无此现象,故可用此法区别溶液和溶胶。
②布朗运动:胶体粒子所作的无规则的、杂乱无章的运动。布朗运动是分子运动的体现。
③电泳现象:在外加电场的作用下,胶粒在分散剂里向阴极或阳极作定向移动的现象。工业生产中可利用电泳现象来分离提纯物质。
|
胶体微粒 |
吸附的离子 |
胶粒带的电荷 |
在电场中胶粒移动方向 |
|
金属氢氧化物、金属氧化物 |
阳离子 |
正电荷 |
阴极 |
|
非金属氧化物、金属硫化物 |
阴离子 |
负电荷 |
阳极 |
例如:在电泳实验中,Fe(OH)3胶体微粒向阴极移动,使阴极附近颜色加深,呈深红褐色;而As2S3胶体微粒向阳极移动,使阳极附近颜色加深,呈深金黄色。
④胶体的聚沉:一定条件下,使胶体粒子凝结而产生沉淀。胶体聚沉的方法主要有三种:a.加入电解质 b.加入与胶粒带相反电荷的另一种胶体 c.加热。如:制皂工业生产中的盐析,江河入海口三角洲的形成等等。
⑤渗析:依据分散系中分散质粒子的直径大小不同,利用半透膜把溶胶中的离子、分子与胶粒分离开来的方法。利用渗析可提纯胶体。
[例3](2008·湖北仙桃) Fe(OH)3胶体中常混有FeCl3和HCl。试回答有关问题:
(1) 实验室制取Fe(OH)3胶体的方法是______________________________________,用__________方法除去胶体中的浑浊;根据____________现象证明胶体已经制成。
(2) 鉴别溶液中存在Fe3+和H+的方法是_____________________________________
_________________________________________________________________________。
(3) 除去胶体中混有的FeCl3和HCl的方法是____________________________。
(4) 如何用实验方法证明胶体和Cl-两者已经分离?______ _______________ _______________________________________________________。
[解析]向沸水中滴加饱和FeCl3溶液可制得Fe(OH)3胶体;利用过滤法可分离浊液和胶体,利用渗析法可分离浊液和胶体;利用丁达尔效应可以检验胶体的存在。
[答案](1)在沸腾的蒸馏水中滴加饱和FeCl3溶液,待溶液呈红褐色,停止加热,即制得胶体 ;过滤 ;丁达尔现象
(2)滴加KSCN溶液,变红色说明有Fe3+,pH试纸检验,变红,说明有H+
(3)渗析(将胶体装入半透膜中,然后置于蒸馏水中)
(4)取半透膜外最后一次的溶液少许于试管中,加入AgNO3溶液,若无沉淀产生,证明两者已经分离。
★ 高考重点热点题型探究
热点一 饱和溶液和不饱和溶液
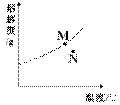 [真题1](2008·常州)右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )
[真题1](2008·常州)右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温再将其升温
D.从M→N:先将M升温再将其蒸发掉部分水
[解题思路]使不饱和溶液转化为饱和溶液和,通常可以通过加入溶质、蒸发溶剂、改变温度等方法去实现。
[解析]有题给A物质的溶解度曲线易知,A物质的溶解度随温度的升高而增大,图中M点为饱和溶液,N点为不饱和溶液。故通过加入溶质A、蒸发溶剂、降低温度,可使N→M;通过加入溶剂、升高温度,可使M→N。
[答案]D
名师指引
溶液的特征是均一、稳定的混合物,与溶液的颜色无关。溶液的浓度大小与该溶液是否是饱和溶液没有必然的联系。在不同的温度条件下,同种物质形成的饱和溶液其浓度是不一样的,溶质的溶解度必须在一定条件下才有意义。
新课导练1
1-1.(2008·苏州)下图是氢氧化钙的溶解度曲线图。现有10℃含l00 g水的澄清氢氧化钙饱和溶液。若把该溶液用水浴加热到60℃(水的蒸发忽略不汁)。下列说法错误的是( )
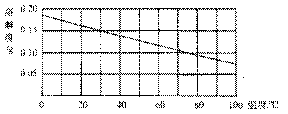 A.溶液变浑浊
A.溶液变浑浊
B.溶液变为不饱和
C.溶液仍饱和
D.溶质质量分数变小
[解析]由氢氧化钙的溶解度曲线图易看出,Ca(OH)2的溶解度随着温度的升高而降低,溶液的温度由10℃上升到60℃,会有Ca(OH)2结晶析出,溶液始终为饱和溶液。
[答案]B
1-2.(2008·沙市三中)下列有关溶液的叙述正确的是( ) A.饱和溶液降低温度时,一定有溶质析出 B.饱和溶液升高温度时,都变为不饱和溶液 C.同温下,一种固体物质的饱和溶液一定比另一种固体物质的不饱和溶液含溶质的质量多 D.一定温度下,某固态物质的饱和溶液,其溶质的质量分数为最大值
[解析]气体物质的溶解度、熟石灰的溶解度都是随着温度的升高而减小,故A、B不正确。同温下,一定量的同种固体物质的饱和溶液比不饱和溶液里溶质的量多,故C不正确。在一定温度下,某固体物质的饱和溶液里所含溶质的质量一定是该温度下的最大值,当然其溶质的质量分数最大,故D正确。
[答案]D
热点二 溶解度、溶质的质量分数的计算
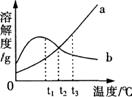 [真题2](2008·哈尔滨)有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )
[真题2](2008·哈尔滨)有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )
A.a物质的溶解度随着温度的升高而增大
B.在t2℃时,a、b两种物质的溶液中溶质的质量
分数一定相等
C.将a、b两种物质的饱和溶液从t3℃降温至t1℃,a有晶体析出,b无晶体析出
D.t3℃时,a物质的溶解度大于b物质的溶解度
[解题思路]溶解度曲线是物质的溶解度随温度变化而变化的曲线,溶解度曲线上的每一个点表示的是在该温度下,100g溶剂里所能溶解的最大溶质的质量(也即该温度下的溶解度)。在其他条件不变时,降低温度,溶液由饱和变为不饱和,溶质会从溶液中析出。
[解析]由右图的溶解度曲线可知:a物质的溶解度是随着温度的升高而增大,t3℃时,a物质的溶解度大于b物质的溶解度,故A、D正确;t2℃时,虽然a、b两种物质溶解度相同,但其溶质的质量、溶液的质量不同,所得的溶液中溶质的质量分数也就不一定相等,故B不正确;把a、b两种物质的饱和溶液从t3℃降温至t1℃时,因a物质的溶解度随温度的降低而降低,而b物质的溶解度随温度的升高而升高,所以a有晶体析出,b无晶体析出,故C正确。
[答案]B
名师指引
题目是千变万化的,答题时,我们应以不变应万变。如果题目要我们求的是溶质的质量分数,则我们只需根据题意先求出溶质的质量和溶剂的质量,然后再利用基本关系式去求其质量分数就行了,切忌弄出很多所谓的公式去胡乱套用。如果是有关溶解度曲线方面的题目,则一定要先仔细观察图象,清楚图象中溶解度随温度变化的情况(曲线的走向),分析出图像中各个端点、转折点、交叉点所表达的意义,再结合题目要求逐一求解。
溶解度曲线是反映物质在水中的溶解度随温度的变化而变化的曲线。根据溶解度曲线,可以查找出某物质在不同温度下的溶解度;可以查找出同一温度下不同物质的溶解度,比较不同物质在同一温度下溶解度的大小。根据曲线中物质的溶解度受温度变化影响的程度,即曲线走势的平缓,可以选择合理的方法来分离提纯物质。例如,如果A物质的溶解度随温度的变化较大,B物质的溶解度随温度的变化较小,则可以通过降温结晶的方法把混合液中的A、B分离出来;如果A、B两物质的溶解度随温度的变化差不多,而两者的溶解度相差较大,则可以通过蒸发溶剂结晶的方法来分离提纯A、B物质。
新课导练2
2-1.(2008·镇江)A图是物质M和N的溶解度曲线。B图中甲、乙试管分别盛有M、N的饱和溶液,试管底均有未溶解的M、N固体。向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质不可能是 ( )
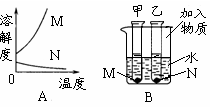
A.浓硫酸 B.硝酸铵固体 C.氧化钙 D.氢氧化钠固体
[解析]由溶解度曲线可知,M的溶解度随温度的升高而增大,N的溶解度随温度的升高而减小,现向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,说明加入该物质后,物质溶解放热,使溶液的温度升高了。分析从A、B、C、D选项,浓硫酸、氧化钙、氢氧化钠固体与水作用,都会放热,只有硝酸铵固体溶解会吸热,故答案为B。
[答案]B
2-2.(2008·重庆一模)某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为( )
A.10% B.15% C.20% D.25%
[解析]由题意知,乙的过程可认为是先蒸发掉35 gH2O,析出晶体5 g,溶液达到饱和。在此基础上,又蒸发掉10 gH2O,又析出晶体5 g由此计算出该温度下KCl的溶解度为50g,再根据析出晶体后剩余的溶液是饱和溶液,可求出余下溶液中KCl的质量,即可得到结果。
[答案]D
热点三 胶体及其性质
[真题3](2008·上海)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将纳米材料分散到液体分散剂中,所得混合物可能具有的性质是(1纳米=10-9m)( )
A.能全部透过半透膜 B.有丁达尔现象
C.所得液体一定是溶液 D.所得物质一定是浊液
[解题思路]利用胶体的性质来解答即可。
[解析]题给中“纳米材料”的直径是几纳米至几十纳米,刚好位于胶体粒子的直径范围(1nm-100nm),溶于水后形成的分散系为胶体,具有胶体的性质。
[答案]B
名师指引
胶体与胶粒是两个不同的概念,胶体不带电,呈电中性,而胶粒带电。性质不同的胶粒带有不同的电荷,同种胶粒则带有相同的电荷,这是胶体较稳定的主要原因。电泳现象则是胶粒带电的具体表现,但不是所有的胶粒都是带电的,如淀粉胶粒就不带电。
新课导练3
3-1.(2006·全国)下列叙述正确的是( )
A.直径介于1nm-100nm之间的微粒称为胶体 B.电泳现象可证明胶体属电解质溶液
C.利用丁达尔效应可以区别溶液与胶体 D.胶体粒子很小,可以透过半透膜
[解析]胶体微粒的直径介于1nm-100nm之间,但直径介于1nm-100nm之间的微粒不一定为胶体,故A不正确;电泳现象说明胶体粒子是带电的,但胶体是电中性的,故B不正确;胶体粒子虽小,但不可透过半透膜,故D不正确。
[答案]C
3-2.(2008·温州二模)生活和生产中常应用到胶体的性质。请看下述例子: (1)做实验时,手指不慎被玻璃划破,可从急救箱中取FeCl3溶液应急止血,其原理是:_________________ _。 (2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的问题。解决方法一是把这些陶土和水一起搅拌,使微粒直径在10-9-10-7m之间,然后插入两根电极,通直流电源,这时阳极聚集______,阴极聚集______,理由是_____ _。 (3)水泥和冶金工厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污3这种作用运用了______ 原理。
[答案](1)电解质FeCl3使血液中蛋白质胶体凝聚。(2)陶土胶粒,氧化铁胶粒,前者吸附负电荷,后者吸附正电荷,在电场作用下发生电泳。(3)电泳
★抢分频道
限时基础训练
2.胶体的分类
 气溶胶--雾、云、烟
气溶胶--雾、云、烟
 按分散剂状态分 液溶胶--Fe(OH)3胶体、蛋白质溶液
按分散剂状态分 液溶胶--Fe(OH)3胶体、蛋白质溶液
胶体 固溶胶--烟水晶、有色玻璃
 按分散质分 粒子胶体-分散质微粒是很多分子或离子的集合体,如Fe(OH)3胶体
按分散质分 粒子胶体-分散质微粒是很多分子或离子的集合体,如Fe(OH)3胶体
分子胶体-分散质微粒是高分子,如淀粉溶液,蛋白质溶液
1.胶体的本质特征:分散质粒子的直径大小在1nm-100nm之间
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com