
14.常温下,下列各组离子在指定环境下能大量共存的是
A.pH=l的溶液中:Na+、K+、SO32-、MnO4-
B.pH=7的溶液中:Na+、A13+、Cl-、SO42-
C.pH>12的溶液中:Na+、K+、SO42-、AlO2-
D.pH=0的溶液中:Na+、K+、NO3-、ClO-
13.二元酸H2A在水中发生电离:H2A=H++HA-和HA- H++A2-,则下列几种物质的水溶液中关系式不正确的是
( )
H++A2-,则下列几种物质的水溶液中关系式不正确的是
( )
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.NaHA:c(Na+)=c(A2-)+c(HA-)
C.Na2A:c(Na+)>c(A2-) >c(OH-)>c(H+)
D.H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-)
12.T °C时气体A与气体B反应生成气体C和固体D。每1 mol A与足量B完全反应时生成1 mol D。反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图②所示。则下列结论正确

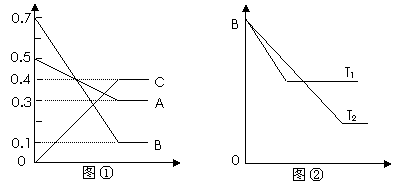 的是
的是
 A.该反应的化学方程式是 A+3B 2C+D
A.该反应的化学方程式是 A+3B 2C+D
B. T°C若向上述平衡体系中加入0.2 mol C,平衡时A的浓度大于0.3 mol/L
C.升高温度,其它条件不变时,,正、逆反应速率均增大,且A的转化率增大
D.相同时间内,消耗0.1 mol/L A时,生成了0.3 mol/L B,反应达到平衡
11.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为
A.11.2 g B.16.8 g C.19.6 g D.22.4 g
10.现有pH=a和pH=b的两种HCl溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于 ( )
A. a-lg2 B. b-lg2 C. a+lg2 D. b+lg2
9.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
8. 25℃时,将两铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极析出了a mol气体,同时有W gNa2SO4•10H2O晶体析出,温度不变时剩余溶液中溶质的质量分数为
A.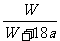 ×100%
B.
×100%
B.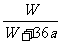 ×100%
×100%
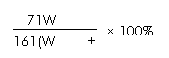
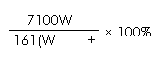
C. D.
7.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆--氧化钇为电解质,这种固体电解质在高温下允许氧离子(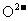 )在其间通过.该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
)在其间通过.该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
( )
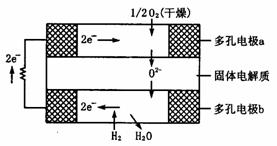
A.有氧气进入发生反应的a极为电池的负极
B.有氢气进入发生反应的b极为电池的正极
C.a极对应的电极反应为: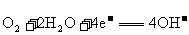
D.该电池的总反应方程式为:
6.在硫酸铝、硫酸钾和明矾的混合溶液中,如果c(SO42-)=0.2mol•L-1,当加入等体积等浓度的KOH溶液时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是
A.0.2mol•L-1 B.0.25mol•L-1 C.0.1mol•L-1 D.0.225mol•L-1
5.下列说法中正确的是
A.C60气化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.氯化钠和氯化氢溶于水时.破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com