
18. 下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是( )
下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是( )
A.电池充电时,阳极电极反应式为:3Br-2e-=Br3-
B.电池放电时,负极电极反应式为:2S22-+2e-==S42-
C.电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3
D.在充电过程中Na+通过膜的流向为从左到右
17.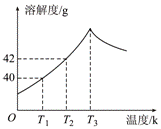 右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1 K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K时Na2SO4的溶解度为( )
右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1 K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K时Na2SO4的溶解度为( )
A.小于40g B.等于40g C.等于42g D.大于42g
16.下列实验中,仪器的下端必须插入液面下的是( )
①制备氢气的简易装置中的长颈漏斗 ②制备氯气装置中的分液漏斗
③制备Fe(OH)2操作中的胶头滴管 ④将氯气溶于水时的导管
⑤用乙醇制取乙烯时的温度计 ⑥分馏石油时的温度计
A.①③⑤ B.②④⑥ C.①③④⑤ D.全部
15.有一可逆反应 2A(g)+3B(g) xC(g),若按下列两种配比在同温同容积的密闭容器中进行反应:
xC(g),若按下列两种配比在同温同容积的密闭容器中进行反应:
(1)0.8molA、1.2molB、1.2molC (2)1.4molA、2.1molB、0.6molC
达到平衡后,C的百分含量相等,则该化学方程式中x的值为( )
A.2 B.3 C.4 D.5
14.能正确表示下列反应的离子方程式是( )
A.向偏铝酸钠溶液中滴加过量盐酸:AlO2-+4H+ Al3++2H2O
Al3++2H2O
B.用NaOH溶液吸收少量二氧化碳气体:OH-+CO2 HCO3-
HCO3-
C.向次氯酸钙溶液中通入少量二氧化硫:
Ca2++ClO-+SO2+H2O CaSO3+2HClO
CaSO3+2HClO
D.向沸水中滴加少量饱和氯化铁溶液:Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
13.工业生产苯乙烯是利用乙苯的脱氢反应:
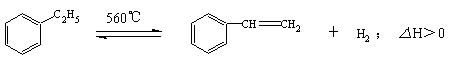
针对上述反应,有人提出如下观点,其中合理的是( )
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率
C.在加入乙苯至达到平衡的过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
12.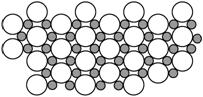 2001年3月发现硼化镁在39 K时呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为( )
2001年3月发现硼化镁在39 K时呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为( )
A.MgB B.MgB2 C.Mg2B D.MgB6
11.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg [c(H+)/c(OH-)] 。常温下,在AG=10的溶液中能大量共存的离子是( )
A、Cu2+、K+、Cl- 、SO42- B、NH4+、Fe3+、I一、SO42-
C、Fe2+、K+、NO3-、Cl- D、Na+ 、K+、ClO-、HCO3-
10.1mol 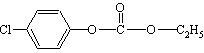 与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是( )
与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是( )
A.3mol B.4mol C.5mol D.6mol
9.用NA表示阿伏加德罗常数,下列说法正确的是( )
A.1mol CH3+ 所含的电子数目为6NA
B.72gC5H12中含有C−C键的数目一定为4NA
C.活泼金属与盐酸反应时,每放出1 mol H2,其电子转移的数目为2NA
D.常温常压下,22.4L NH3所含的电子数目为10NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com