
3.恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-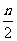 )
)
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.当v正(A)=2v逆(B)时,可确定反应达平衡
2.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸 B.漂白剂 C.还原剂 D.氧化剂
1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300-500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。根据以上叙述回答1、2两小题:
1.对于C60与棒碳,下列说法正确的是
A.C60在一定条件下可能与CuO发生置换反应 B.棒碳不能使溴水褪色
C.C60与棒碳中所有的化学键都是非极性共价键 D.棒碳与乙炔互为同系物
18.一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
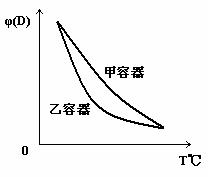
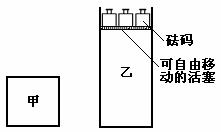
关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
17.卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,例如:CH3Br+OH-(或NaOH)→CH3OH+Br-(或NaBr)。下列反应的化学方程式中,不正确的是
A.CH3CH2Br+NaHS→CH3CH2HS+NaBr
B.CH3I+CH3ONa→CH3O CH3+NaI
C.CH3CH2Cl+CH3ONa→CH3Cl+CH3CH2ONa
D.CH3CH2Cl+CH3CH2 ONa→(CH3CH2)2O+NaCl
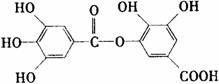
16.某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是
A.该有机物遇氯化铁溶液呈紫色
B.1mol该有机物能与6mol氢氧化钠反应
C.该有机物不能溶于水
D.在稀硫酸存在下可以发生水解反应,但水解的产物只有一种有机物
15.在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:
A(s)+ 2B(g)  C(g)+ D(g)已达平衡状态的是
C(g)+ D(g)已达平衡状态的是
A.混合气体的密度 B.混合气体的压强
C.混合气体的体积 D.C气体的物质的量
14.由于碘是卤族元素中原子半径较大的元素,可能呈现金属性。下列事实能够支持这个结论的是
A.已经制得了I2O5等碘的氧化物
B.在IBr、ICl等卤素互化物中碘元素表现正价
C.已经制得了I(NO3)3、I(ClO4)3·2H2O等离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3-
13.强酸和强碱稀溶液的中和热可表示为 H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1
已知:①HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为
A.a>b>c B.b>c>a C.a=b=c D.无法比较
12.有镁、铝合金14.7g,全部溶于500mL6.0mol/L的盐酸中充分反应后,再加400mL8.0mol/L的NaOH溶液,结果得到沉淀26.3g,则合金中镁、铝的质量分别为
A.13.5g和1.2g B.10 .2g和4.5g
C.1.2g和13.5g D.10.9g和3.8g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com