
8.由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A 2:1 B 1:1 C 1:2 D 1:3
6.下列各组物质各自形成的晶体,均属于分子晶体的化合物是 ( )
A NH3,HD,C10H8 B PCl3,CO2,H2SO4 C SO2,SiO2,P2O5 D CCl4,Na2S,H2O2
7 下列物质属于分子晶体的化合物是 属于原子晶体的单质是
A 石英 B硫磺 C 干冰 D 食盐 E 金刚石 F刚玉 G二氧化硅 H干冰
5.能与氢氧化钠溶液反应的原子晶体是 ( )
A、铝 B、金刚石 C、硅 D、二氧化硅
4.实现下列变化时,需克服相同类型作用力的是 ( )
A. 二氧化硅和干冰的熔化 B. 液溴和液汞的气化 C. 食盐和冰的熔化 D. 纯碱和烧碱的熔化
3.下列化学式可表示一个分子的是 ( )
A. SiO2 B. NH4Cl C. CCl4 D. C
1、1.下列物质为固态时,必定是分子晶体的是
A. 酸性氧化物 B. 非金属单质 C. 碱性氧化物 D. 含氧酸
3、金属一般可形成金属晶体
[例2]、.关于化学键的下列叙述中,正确的是( ).
(A)离子化合物可能含共价键 (B)共价化合物可能含离子键
(C)离子化合物中只含离子键 (D)共价化合物中不含离子键
[点拨]化合物只要含离子键就为离子化合物。共价化合物中一定不含离子键,而离子化合物中还可能含共价键。答案 A、D
[巩固]下列叙述正确的是
A. P4和NO2都是共价化合物
B. CCl4和NH3都是以极性键结合的极性分子
 C. 在CaO和SiO2晶体中,都不存在单个小分子
C. 在CaO和SiO2晶体中,都不存在单个小分子
D. 甲烷的结构式: ,是对称的平面结构,所以是非极性分子
答案:C
题型二:各类晶体物理性质(如溶沸点、硬度)比较
[例3]下列各组物质中,按熔点由低到高排列正确的是( )
A O2 、I2 Hg B、CO2 KCl SiO2 C、Na K Rb D、SiC NaCl SO2
[点拨]物质的熔点一般与其晶体类型有关,原子晶体最高,离子晶体(金属晶体)次之,分子晶体最低,应注意汞常温液态选B
[例4]碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是
A. ①③② B. ②③① C. ③①② D. ②①③
[解析]由于题给的三种物质都属于原子晶体,而且结构相似都是正四面体形的空间网状结构,所以晶体的熔点有微粒间的共价键强弱决定,这里共价键强弱主要由键长决定,可近似地看作是成键原子的半径之和,由于硅的原子半径大于碳原子,所以键的强弱顺序为C-C>C-Si>Si-Si,熔点由高到低的顺序为金刚石>碳化硅>晶体硅。本题正确答案为A。
[题型三]成键原子最外层8电子结构判断,离子化合物、共价化合物电子式书写判断
[例5] 下列分子中所有原子都满足最外层8电子结构的是 A、光气(COCl2) B、六氟化硫 C、二氟化氙 D、三氟化硼
[解析]光气从结构式可看出各原子最外层都是8电子结构,硫最外层6个电子,氙最外层已有8个电子分别形成二氟化物、六氟化物最外层电子数必超过8,硼最外层3个电子,分别与氟形成3个共价单键后,最外层只有6个电子。
[题型四]根据粒子、晶体的空间结构推断化学式,将掌握晶体结构知识在新情境下进行应用。
[例6]第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类 1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳五个CH4分子或1个游离H2O分子。根据上述信息,完成第1、2题:
(1).下列关于天然气水合物中两种分子极性的描述正确的是
A 两种都是极性分子 B 两种都是非极性分子
C CH4是极性分子,H2O是非极性分子 D H2O是极性分子,CH4是非极性分子
(2).若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为
ACH4·14H2O B CH4·8H2O C CH4·(23/3)H2O D CH4·6H2O
[点拨]晶体中8个笼只有6个容纳CH4分子,另外2个笼被水分子填充,推出8个笼共有6个甲烷分子,46+2=48个水分子。答案(1)D(2)B
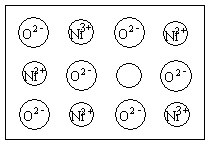 [例7]⑴中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
[例7]⑴中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
⑵天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图4-4所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
图4-1
















 [解析]晶胞中阴、阳离子个数的确定通常采用“原子分割法”,具体如下:①处于顶点的离子,同时为8个晶胞共有,每个离子有1/8属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有1/4属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞;④处于内部的1个离子,则完全属于该晶胞,该离子数目为1。要确定NiO的密度,就应确定单位体积中NiO分子的个数,再结合NiO的摩尔质量求算出该晶体中NiO的质量,最后求出密度。本题解答如下:
[解析]晶胞中阴、阳离子个数的确定通常采用“原子分割法”,具体如下:①处于顶点的离子,同时为8个晶胞共有,每个离子有1/8属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有1/4属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞;④处于内部的1个离子,则完全属于该晶胞,该离子数目为1。要确定NiO的密度,就应确定单位体积中NiO分子的个数,再结合NiO的摩尔质量求算出该晶体中NiO的质量,最后求出密度。本题解答如下:
 ⑴如图4-5所示,以立方体作为计算单元,此结构中含有
⑴如图4-5所示,以立方体作为计算单元,此结构中含有
Ni2+-O2-离子数为:4×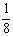 =
=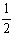 (个),所以1molNiO晶体中应含有
(个),所以1molNiO晶体中应含有
此结构的数目为6.02×1023÷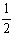 =12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
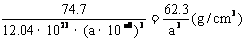
⑵解法一(列方程):设1molNi0.97O中含Ni3+为xmol,Ni2+为ymol,则得
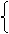 x+y=0.97 (Ni原子个数守恒)
x+y=0.97 (Ni原子个数守恒)
3x+2y=2 (电荷守恒)
解得x=0.06,y=0.91,故n(Ni3+):n(Ni2+)=6:91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有
 Ni3+ 3
0.06/0.97
Ni3+ 3
0.06/0.97
 2/0.97
2/0.97
Ni2+ 2 0.91/0.97
故n(Ni3+):n(Ni2+)=6:91。
[随堂作业]
2、含共价键的单质、化合物多数形成分子晶体,少数形成原子晶体如金刚石、晶体硅、二氧化硅等。
2、掌握各类晶体的物理性质,构成晶体的基本粒子及相互作用,能判断常见物质的晶体类型。
[经典题型]
[题型一]化学键类型、分子极性和晶体类型的判断
[ 例1 ]4.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 [ ]
(A)SO2和SiO2 (B)CO2和H2 (C)NaCl和HCl (D)CCl4和KCl
[点拨]首先根据化学键、晶体结构等判断出各自晶体类型。A都是极性共价键,但晶体类型不同,选项B均是含极性键的分子晶体,符合题意。C NaCl为离子晶体,HCl为分子晶体
D中CCl4极性共价键,KCl离子键,晶体类型也不同。
规律总结 1、含离子键的化合物可形成离子晶体
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com