
3、能共存或不能共存(不强调大量共存)
[随堂作业]
2、特殊要求:如在××离子存在下不能共存的;因发生氧化还原反应,而不能大量共存的;因生成沉淀和气体而不能大量共存的等。
1、对溶液性质的要求:
(1)颜色:无色透明溶液中一定无Cu2+、Fe2+、Fe3+、MnO4-
(2)溶液的酸碱性:如25℃时由水电离出的C(H+)或C(OH-)=1.0×10-12 mol/L;与Al作用产生氢气;室温时某指示剂的颜色(如酚酞变红);室温下PH=1或13的溶液等。
3、 强酸、强碱性溶液都不能大量存在:即多元弱酸的酸式酸根离子,
如:HS-、HCO3-、HSO3-、HPO42-、H2PO4-
2、只能存在于碱性溶液中:水解呈碱性的离子,
即弱酸根:如CH3COO-、CO32-、S2-、HS-、HCO3-、PO43-、HPO42-、F-、H2PO4-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、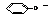 等
等
1、只能存在于酸性溶液中:水解呈酸性的离子,
即弱碱所对应的阳离子:如Fe3+、Al3+、Fe2+、NH4+等
4、氧化还原反应:如
氧化性离子:Fe3+、MnO4-、NO3-(酸性条件下)、ClO-
还原性离子:S2-、I- ; Fe2+
(其中只有Fe3+ 与Fe3+可以共存)
3、络合反应:如Fe3+与SCN-
2、双水解反应:弱酸所对应的阴离子与弱碱所对应的阳离子互相促进双水解进行到底
如:Al3+ 与CO32-、S2-、HCO3-、AlO2-; NH4+与SiO32-、AlO2- ;Fe3+ (Fe2+)与CO32-、HCO3-、AlO2-等
1、离子互换反应(复分解反应):
(1) 生成沉淀(难溶或微溶性物质)如:CaCO3、Mg(OH)2、BaSO4、AgSO4等
(2) 生成气体(挥发性物质)如:CO2、NH3、H2S等
(3) 生成难电离的物质(弱电解质)如:CH3COOH、NH3·H2O、H2O等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com