
15.下图是金属晶体内部的电气理论示意图
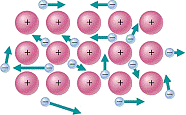
仔细观察并用电气理论解释金属导电的原因是
A.金属能导电是因为含有金属阳离子
B.金属能导电是因为含有的自由电子在外电场作用下做定向运动
C.金属能导电是因为含有电子且无规则运动
D.金属能导电是因为金属阳离子和自由电子的相互作用
14.下列各物质的晶体中,晶体类型相同的是
A.O2和SiO2 B.NaI和I2 C.CO2和H2O D.CCl4和NaCl
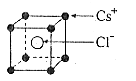
13.已知CsCl晶体的密度为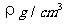 ,NA为阿伏加德罗常数,相邻的两个
,NA为阿伏加德罗常数,相邻的两个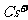 的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
A.  B.
B.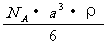
C. 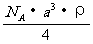 D.
D.
12.已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和直线型分子M。(组成E分子的元素的原子序数小于10,组成G分子的元素为第三周期的元素。)如下图,则下列判断中正确的是

(E) (G) (L) (M)
A. 常温常压下,L是一种液态有机物 B.E中化学键是极性键
C.G有漂白性 D.上述反应的类型是加成反应
11.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
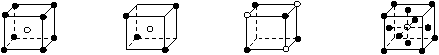
A B C D
10.下列有关叙述正确的是
A.已知NaH是离子化合物,则其电子式是 Na+[:H]-
B.在PCl5分子中,磷原子满足最外层8电子结构
C.在BCl3分子中,所有原子都满足最外层8电子结构
D.石墨晶体是层状结构,在同一层上平均每个正六边形所含有的碳原子数为2
9.下列各组物质的空间构型完全不同的是
A. NH3和H3O+ B. NH4+和CH4 C. CO2和SiO2 D. 金刚石和晶体硅
8.现有如下各说法:
①在水中氢、氧原子间均以化学键相结合。
②金属和非金属化合形成离子键。
③离子键是阳离子、阴离子的相互吸引。
④根据电离方程式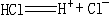 ,判断HCl分子里存在离子键。
,判断HCl分子里存在离子键。
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程。
上述各种说法正确的是
A、①②⑤正确 B、都不正确
C、④正确,其他不正确 D、仅①不正确
7.1999年曾报导合成和分离了含能量的正离子N5+的化合物N5AsF6,下列错误的是
A、N5+共有34个核外电子 B、N5+中氮原子之间以共用电子对结合
C、化合物N5AsF6中As化合价为+1 D、化合物N5AsF6中F化合价为-1
6.能与NaOH溶液反应的属于原子晶体的化合物是
A.金刚石 B.晶体硅 C.石英(SiO2) D.CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com