
读下图,完成1-3题。
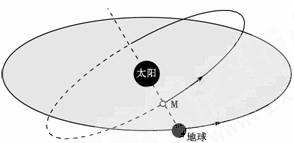
1.图中天体M可能是 ( )
①水星 ②火星 ③天王星 ④金星 ⑤木星 ⑥土星 ⑦海王星
A.②⑥ B.④⑤ C.③⑦ D.①④
2.图中的阴影区表示的是 ( )
A.黄道面 B.赤道面 C.地球公转轨道 D.赤道
3.图中箭头显示了 ( )
A.共面性 B.同向性 C.近圆性 D.随意性
32.(7分) 磷单质及其化合物的、有广泛应用。
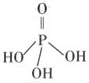 (1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
(1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g);
 H
H
上述反应中,副产物矿渣可用来 。
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个水分子产物,其
结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
Ni2+ + H2PO2-+ → Ni++ H2PO3-+
31.(9分)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =4LiCl+S +SO2。 请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
30.(9分)铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S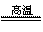 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请写出粗铜电解得到精铜的电极反应式:阳极 ;阴极 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
29.(7分)有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I-、NO3-、CO 、SO
、SO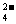 、AlO
、AlO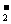 ,取该溶液进行以下实验:
,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除 的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除 存在。
(3)另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除 的存在。
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明有 的存在,又可以排除 的存在。
(5)根据上述实验事实可以确定,该溶液中肯定存在的离子是 ,还不能确定是否存在的离子是 。
28.(8分)下表列出了前20号元素中的某些元素性质的有关数据:
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 、 (写两种分子的分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是 ;电解⑧和R的某种熔融化合物时,当阴极消耗 2 mol 该化合物的正离子时,阳极可得3 mol单质,。由此可推断得知该盐的化学式是 (填化学式)。其阳极上所发生的电极方程式是: ________ __________。
27.(8分)已知:在热力学标准态(298K、1.01×105Pa)
 下,由稳定的单质发生反应生成1mol化合物的反
下,由稳定的单质发生反应生成1mol化合物的反
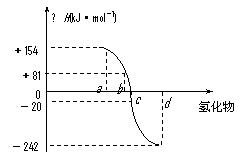
应热叫该化合物的生成热(△H)。右图为氧族元
素氢化物a、b、c、d的生成热数据示意图。试回
答下列问题:
(1)写出氧族元素中含有18e-的两种氢化物的电
子式 、 。
(2)请你归纳:非金属元素氢化物的稳定性与氢
化物的生成热△H的关系
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:
26.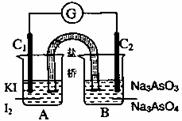
 将AsO
将AsO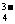 +2I-+2H+
AsO
+2I-+2H+
AsO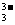 +I2+H2O设计成右下图所示的电化学装,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
+I2+H2O设计成右下图所示的电化学装,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
甲组:向B烧杯中逐滴加入浓盐酸 乙组:向B烧杯中
逐置滴加入40%NaOH溶液
下列描述中,正确的是( )
A.甲组操作过程中,C2做负极
B.乙组操作过程中,C1上发生的电极反应为: 2I--2e-=I2
C.两次操作过程中,微安表(G)指针的偏转方向相反
D.甲组操作时该装置为原电池,乙组操作时该装置为电解池
25.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是 ( )
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
24.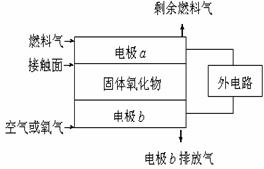 固体氧化物燃料电池(SOFC)以固体氧化物作为
固体氧化物燃料电池(SOFC)以固体氧化物作为
电解质。其工作原理如右图所示:下列关于固
体燃料电池的有关说法正确的是 ( )
A.电极b为电池负极,电极反应式为
O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应
为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为
C2H4+6O2--12e-=2CO2+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com