
24、(1)10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O(2分)
(2)5(2分) ⑶<(2分) 5(a+5)/(a+3) (2分)
23.(1)MnO2 + 4HCl(浓)==?MnCl2 + H2O + Cl2↑(1分)(其它合理答案都给分) (2)饱和食盐水(1分)
(3)Ⅱ可行,Ⅲ不行(1分)。Ⅱ与Ⅰ原理相同(1分),而Ⅲ中因c瓶口密封,体积不能改变,增大压强会有危险(1分)
(4)a、观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置(1分)
b、C:溶液由浅绿色变为深红棕色D:溶液变蓝
E:生成白色沉淀。F:溶液变为黄绿色(4分)
(5)C + 2H2O+ 2Cl2 = CO2↑+ 4 HCl↑(1分)向G中提供反应所需的水蒸气(1分) (6)生成的HCI使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去(1分)
(7)B(1分)
(8)关闭Ⅰ处活塞。(1分)作用:贮存多余的氯气。(1分)
24、在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
(1)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为
_________________________________。
(2)该石灰乳中含有Ca(OH)2的物质的量是____ ___ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通 入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若 ,则n(C1-)=
mol(用含a的代数式来表示)。
,则n(C1-)=
mol(用含a的代数式来表示)。
慈溪中学09学年高三第一学期期中测试
化 学 参 考 答 案
(1-9每题2分,10-17每题3分)
18(6分)(1)⑤⑥⑦⑧(对二个得1分,错选1个扣1分)(2分)
(2)①N2H4+H2O NH2NH3+(或N2H5+)+
OH-(2分)
NH2NH3+(或N2H5+)+
OH-(2分)
②CO(NH2)2+
NaClO+ 2NaOH =(高锰酸钾催化剂) N2H4+NaCl+Na2CO3
+H2O(高锰酸 钾催化剂,不写扣一分)(2分)
钾催化剂,不写扣一分)(2分)
19(7分)(1)2Fe2++Cl2=2Fe3++2Cl-(2分)
4NH3+5O2 Pt=△ 4NO+6H2O (2分)
(3)2C+SiO2 Si+2CO↑(2分)
(1分)
Si+2CO↑(2分)
(1分)
20(7分)(1)CuI、I2(2分) (2)2Cu+I2 =2CuI↓(2分)
(3)>,高(2分) (4)a c(1分)(漏选、错选、多选不得分)
21(8分)(1) SO2, NaCl (2分)
 (1分)
(1分)
 (2分)
(2分)
(3)变红色(1分);SO2+Cl2+2H2O=2HCl+H2SO4(2分
22(6分)答案:(1)将收集到的气体点燃,若能燃烧或发出爆鸣声则证明该气体是氢气。(1分)
(2)乙醇分子中含有乙基和羟基而水分子中含羟基,(1分)乙醚分子中含有乙基。(1分)
(3)羟基氢可和钠发生置换反应(1分);乙基上的氢不能和钠发生置换反应(1分);2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(1分)
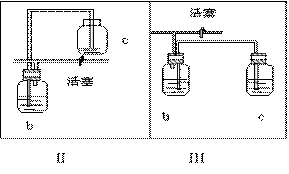
23. (16分)如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(氢硫酸)、C(溴化亚铁溶液)、D(碘化钾淀粉溶液)、E(混有二氧化硫的氯化钡溶液)、F(水)、H(紫色石蕊试液)

(1)A是氯气发生装置,其化学反应方程式是: __________。
(2)Ⅰ中b瓶内宜加入的液体最好是 。
(3)用图示的Ⅱ或Ⅲ代替Ⅰ是否可行? 。简要说明 理由 。
(4) 实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装
置,再点燃G处酒精灯,回答下列问题: a、怎样证明氯气已充满了整个装置 ?______________ b、下列装置中的现象是 C ; D ; E ; F 。 (5)G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为二氧化碳、和氯化氢,
写出G中的反应的化学方程式 。装置F的作用是 。
(6)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
。
 (7)若将H处的烧杯中的溶液改为澄清的石灰水,反应过程中的现象为
(选
(7)若将H处的烧杯中的溶液改为澄清的石灰水,反应过程中的现象为
(选
填标号)
A、有白色沉淀 B、无现象 C、先生成白色沉淀而后消失 (8)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯
气产生,此时应该怎样操作 ;装置Ⅰ的作用是__ ____。
22、(6分) 为了探究乙醇和金属钠反应的原理,做了如下四个实验:
实验一:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体。
实验二:设法检验实验一收集到的气体。
实验三:向试管中加入3 mL水,并加入一小块金属钠,观察现象。
实验四:向试管中加入3 mL乙醚,并加入一小块金属钠,观察现象。
回答以下问题:
(1)简述实验二中检验气体的实验方法及作出判断的依据: 。
(2)从结构上分析,该实验选取水和乙醚做参照物的原因是 。
(3)实验三的目的是欲证明 ;实验四的目的是欲证明 ;根据实验三和实验四的结果,可以证明乙醇和金属钠反应的化学方程式应为 。
21、(8分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:

若E和F均为有刺激性气味的气体,H不溶于酸,请填写下列空白。
(1)气体F的化学式为 ,C中溶质的化学式为 。
(2)写出下列反应的离子方程式:
C→E ; D+G→H ;
(3) 在混合溶液G中若滴入几滴石蕊溶液,可见现象为 ,
原因是____________________________________(用化学方程式表示)
20、(7分).已知:CuI是难溶于水的白色固体。氧化性Cu2+>I2> Cu+, 还原性Cu>I-> Cu+
(1)根据物质氧化性还原性的强弱推测,在溶液中Cu2+和I-反应的产物是 、 ;
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为_______________________;
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性H2S_______(填“>”、“<”、“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度________(填“高”、“低”、“相等”);
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg=Cu2HgI4(亮黄色)+2Cu。下列关于该化学方程式的说法错误的是_____________。
a. 该反应被氧化的元素是铜元素和汞元素 b.该反应的氧化剂为CuI
c.Cu2HgI4既是氧化产物又是还原产物
19、(7分) A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
(1)若A是常见的金属单质,D、F是气态单质,反应①在水 溶液中进行,则反应②(在水溶液中进行)的离子方程式是_________________________。
(2)若B、C、F都是气态单质,且B有毒,③的反应中还有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是_________________,
反应③的化学方程式是______________________________。
(3)若A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是 。
18.(6分)(1)有以下八种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(C1O)2;④CaC12;⑤Na2CO3;⑥NaA1O2;⑦NH3和NaC1;⑧苯酚钠。向其中分别持续通入CO2,最终能得到沉淀或析出晶体的是_________________________

(2)根据下列描述写出下列化学方程式:
① 联氨(N2H4)是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素(CO(NH2)2)和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式 。
17、某Al2(SO4)3和Na2SO4的混合溶液中,已知C(Al3+):C(Na+) == 1:2,若C(SO42-) == 2.5
mol/L,则C(Al3+)为
A.0.5 mol/L B. l mol/L C.2 mol/L D.3mol/L

第I卷(58分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com