
5.“常记溪亭日暮,沉醉不知归路。兴尽晚回舟,误人藕花深处。争渡,争渡,惊起一滩鸥鹭。”开幕式上的吟唱与表演,仿佛摇曳了千年的记忆。该词的作者是
A.辛弃疾 B.李清照 C.陆游 D.蔡文姬
4.开幕式上,民歌 贯穿始终。通过管弦乐和民乐的结台,赋予这首歌曲时尚、现代的音乐气息,把简单的音乐旋律,变奏成宏大温暖的交响,给人一种意境深远、力量无穷的心灵震撼。
A.《茉莉花》 B.《淮不说俺家乡好》 C.《沂蒙山小调争》 D.《幸福歌》
3. 党的十七大指出:构建社会主义和谐社会,关键在党。这是因为
党的十七大指出:构建社会主义和谐社会,关键在党。这是因为
A.中国共产党的宗旨是全心全意为人民服务
B.中国共产党是我国的执政党,是社会主义事业的领导核心
C.中国共产党能够实行强有力的宏观调控
D.党为构建社会主义和谐社会提供物质保证
2.在我国传统文化中,有着深厚的“和谐”理念有对其研究的学者,将“和谐意识”视为“中国文化人文精神的精髓和首要价值”。下列与此不相符合的是
A.“天地合而万物生,明阳接而变化起。”B.“人与天调,然后天地之美生。”
C.“礼之用,和为贵。” D.“先天下之忧而忧,后天下之乐而乐”
1.“和谐中国”是唱响当今中国社会的主旋律。下列名言,对当今中国构建和谐叹际关系具有启迪作用的是
A.“己欲立而立人,己欲达而达人。” B.“非攻,兼爱。”
C.“发愤忘食,乐以忘忧,不知老之将至” D.“白沙在涅,与之俱黑。”
26.(10分)汽车或飞机行驶速度越高,单位时间内燃料燃烧速度越快,产生温度越高,越可能达到N2与O2反应的条件,生成NO在空气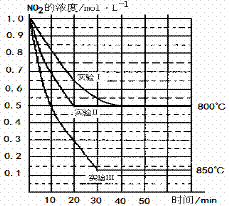 中部分被氧化成NO2 ,用NOx
中部分被氧化成NO2 ,用NOx 可以表示空气中氮氧化物。
可以表示空气中氮氧化物。
 则2NO(g) + O2
(g) = 2NO2 (g) ΔH=
kJ·mol―1。
则2NO(g) + O2
(g) = 2NO2 (g) ΔH=
kJ·mol―1。
(2)NOx对平流层O3浓度减少,形成臭氧空洞的机理可以用如下图示解释:
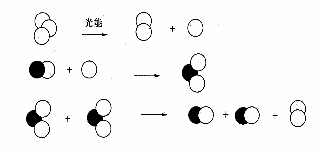
则平流层臭氧浓度减小的总反应化学方程式为: 。
(3)在2 L密闭容器中反应2NO2(g)
 2NO(g)+O2(g) 在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L―1)随时间(min)的变化如图所示(不考虑生成N2O4)。试填空。
2NO(g)+O2(g) 在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L―1)随时间(min)的变化如图所示(不考虑生成N2O4)。试填空。
① 对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结 论中正确的是: 。(填字母)
A.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
B. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
C.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂
D.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
② 若实验Ⅰ中达平衡后,再向密闭容器中通入1 mol由物质的量之比为
1︰1组成的NO2与NO混合气体(保持温度不变),则平衡将
移动,新条件平衡状态时NO2的物质的量浓度为: mol·L―1。
25.(7分) A、B、C、D、E、F六种中学化学中常见的物质,它们之间的转化关系如图所示: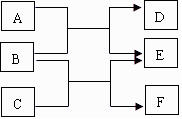
(1)若A、C、E皆为氧化物,且E为有毒气体;B、D、F皆为非金属单质,且D为气体。则单质F的晶体类型为 ,B和C反应生成E和F的化学方程式是: 。
(2)若B、D、F皆为氢化物,三者皆为极性分子,其中B和D是同主族元素形成的;C是气态单质,E是固态单质,上述反应都在常温下进行。
①A与B反应生成D和E的化学方程式为 。
②C通入到A的水溶液中,会发生反应,其离子方程式为 。
24.(10分)下表是部分短周期元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
Q |
|
原子半径/nm |
0.037 |
0.186[来 |
0.074 |
0.075 |
0.077 |
0.110 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
-3、+5 |
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位置是 。
(2)Y的氢化物比Q的氢化物沸点高的原因是 。
(3)X与R按1∶1的原子个数比形成化合物甲,甲中存在的化学键有 ;X可与W组成含18e-的化合物乙,则乙的电子式为 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键。1 mol丙气体可与2 mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式 。
23.(8分)5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。
当1 mol HClO2发生分解反应时,转移的电子数是 个
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中氧化剂与还原剂的物质的量之比为 。
22.(10分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
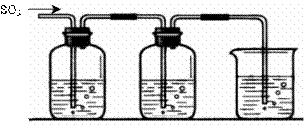
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(1)SO2与FeCl3溶液反应的离子方程式为 。
(2)下列实验方案适用于在实验室制取所需SO2的是
(填序号)。
A.Na2SO3溶液 与HNO3
B.Na2SO3固体与浓
与HNO3
B.Na2SO3固体与浓 硫酸
硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F. 坩埚
(4)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不 变红,再加入新制的氯水,溶液变红
变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 , 原因是
(5)能表明I-的还原性弱于SO2的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com