
19.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO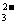 和OH-
和OH-
B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大 到小的顺序是:c(Na+)>c(CH3COO-)>cOH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
18.室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。
已知CaCO3的溶度积(室温)为2.8×10-9,下列说法 中不正确的是( )
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成a点
D.b点与d点对应的溶度积相等
17.二氧化硫催化氧化反应(接触法制硫酸):2SO2(g)+O2(g) 2SO3(g)
△H=-196kJ·mol-1 有关叙述错误的是( )
A.一定温度下,增大压强,转化率增大,平衡常数不变
B.2molSO2和1molO2反应放出热量小于196kJ
C.反应物键能之和小于生成物键能之和
 D.焓变△H和熵变△S都有利于反应正向进行
D.焓变△H和熵变△S都有利于反应正向进行
16.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为
KOH溶液,其充、放电按下式进行:
.. Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
.. 有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 -e- + OH- == NiOOH + H2O
B.电池充电时,电池正极和电源的负极连接。
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
15.某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g) H>0当反应达平衡时,测得容器中各物质均 为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可采用的是( )
H>0当反应达平衡时,测得容器中各物质均 为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可采用的是( )
A、升温 B、加催化剂
C、再加入n molCO和n molH2O D、再加入2n molCO2和2n molH2
13.高温下,某反应达到平衡,平衡常数K=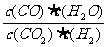 。恒容时,温度升高,H2浓 度变大。下列说法正确的是( )
。恒容时,温度升高,H2浓 度变大。下列说法正确的是( )
A.该反应是焓变为负值
B.恒温下,增大压强,H2浓度一定减小
 C.升高温度,逆反应速率减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2
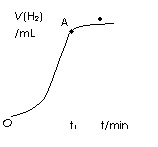

|
为ρ g/cm3)。下列叙述错误的是( )
A.t1时刻锌镀层已完全反应
B.锌镀层的厚度为
C.反应放热也是影响OA段的反应速率的因素之一
D.有原电池反应发生,负极的电极反应式为Zn- 2e → Zn2+
12.常温下,有甲、乙两份体积均为1 L、浓度均为0.1 mol/L的氨水,其pH为11。①甲 用蒸馏水稀释100倍后,溶液的pH变为a;②乙与等体积、浓度为0.2 mol/L的盐酸 混合,在混合溶液中:n(NH4+ )+n(H+)-n(OH-) = b mol。则a、b正确的答案组合是 A.9-11之间;0.1 B.9-11之间;0.2 ( )
C.12-13之间; 0.2 D.13;0.1
11.在二氧化碳的水溶液中存在着如下平衡:
C02(g) C02(aq) C02(aq)+H20H2C03(aq)
H2C03(aq) H+ (aq)+HCO3-(aq) HCO3-(aq) H+(aq)+CO32-(aq)
下列有关说法正确的是( )
A.水中溶解的二氧化碳的浓度,夏天时比冬天时高
B.如果海水略呈碱性,海水中二氧化碳的浓度比纯水高
C.气压升高,水中c(HCO3-)增大
D.常温下,二氧化碳的水溶液中,由水电离出的c(H+)与c(OH-)的乘积等于1×lO-14
10.将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管 中,并按下图装置好仪器,观察下图,示意正确的是( )
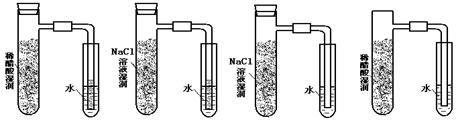
A B C D
9.下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH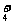 +HCO
+HCO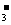
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3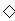 +2HClO
+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO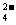 =CaSO4
=CaSO4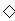 +H2O
+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com