
11.(12分)(08年山东理综·29)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH3CH
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2=32.4 kJ·mol-1
CH(g ) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
答案:
(1)124.2
(2)C3H8+5O2=3CO2+4H2O 负
(3)4.2×10-7 mol·L-1
(4)> HCO3-+H2O=CO32-+H3O+(或HCO3-=CO32-+H+)、HCO3-+H2O=H2CO3+OH-,HCO3-的水解程度大于电离程度
10.(11分)(08年广东化学·19)
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
 回答下列问题:
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若在实验室进行“趁热过滤”,可采取的措施是
(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是 。
(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
答案:(1)Mg(OH)2、Fe(OH)3、CaCO3
(2)使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长
(3)用已预热的布氏漏斗趁热抽滤
(4)溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质 其原因:"母液"中,含有的离子有Ca2+,Na+,Cl-,SO42-,OH-,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀
(5)Na2CO3·H2O(s)=== Na2CO3(s) + H2O(g)△H= +58.73kJ·mol-1
9. (07年山东理综·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(07年山东理综·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)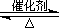 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni=由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
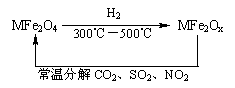

请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
答案:(1)①800L·mol-1 ②= (2)1.60NA(或1.6NA) 173.4 (3)MFe2Ox+SO2→MFe2O4+S
8. (09年海南化学·12)已知:Fe2O2(s)+C(s)= CO2(g)+2Fe(s) △H=234.1kJ·mol-1
(09年海南化学·12)已知:Fe2O2(s)+C(s)= CO2(g)+2Fe(s) △H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
 则2Fe(s)+O2(g)=Fe2O3(s)的△H是
则2Fe(s)+O2(g)=Fe2O3(s)的△H是
A.-824.4kJ·mol-1 B.-627.6kJ·mol-1
C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
答案:A
7.(09年广东文基·68)下列说法正确的是
A.废旧电池应集中回收,并填埋处理
B.充电电池放电时,电能转变为化学能
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
答案:C
5.(08年海南化学·8)白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(6a+5d-4c-12b)kJ·mol-1 B(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
答案:A
6 .(09年天津理综·6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566
kJ/mol
.(09年天津理综·6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566
kJ/mol

 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+
 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是
 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
 B.右图可表示由CO生成CO2的反应过程和能量关系
B.右图可表示由CO生成CO2的反应过程和能量关系
 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
 D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
答案:C
4.(08年宁夏理综·13)已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
答案:A
3.(2007海南·06)已知:
(1)Zn(s)+1/2O2(g)==ZnO(s);ΔH=-348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)== Ag2O(s);ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol
答案:A
2.(07年广东文基·62)下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
答案:B
1.(07年山东理综·12)下列叙述正确的是
A.16 8O2和18 8O2互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s) △H>0,所以石墨比金刚石稳定
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com