
2. 金属性最强的在周期表的左下角是,Cs;非金属性最强的在周期表的右上角,是F。
1. 周金属性、非金属性之间没有严格的界线。在分界线附近的元素具有两性;
以第三周期元素性质变化规律为例: Na Mg Al Si P S Cl
 金属性逐渐减弱,非金属性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
金属性减弱表现:碱性 NaOH > Mg(OH)2> Al(OH)3
非金属性增强表现:稳定性: SiH4<PH3<H2S<HCl 酸性:H2SiO3<H3PO4<H2SO4<HClO4
例12.用元素符号回答原子序数11-18号的元素的有关问题。
(1)最高价氧化物的水化物碱性最强的是 Na 。
(2)最高价氧化物的水化物酸性最强的是 Cl 。
(3)最容易生成氢化物且最稳定的是 Cl 。
例13. 稳定性强弱:HF HCl HBr HI NH3 HF NH3 PH3
例14. 碱性强弱:KOH NaOH Mg(OH)2
例15. 酸性强弱:HClO4 HBrO4 HNO3 H3PO4
2.最高正化合价和最低负化合价:

 随着原子序数的递增,元素正化合价从+1 +7,负化合价,由-4 -1变化。
随着原子序数的递增,元素正化合价从+1 +7,负化合价,由-4 -1变化。
注意:(1)O、F无正价,金属无负价
(2)最高正化合价=最外层电子数=主族序数
(3)最高正化合价+∣最低负化合价∣=________
例10.在下列元素中,最高正化合价数值最大的是( )
A.Na B.P C.Cl D.Ar
例11.下列各组指定原子序数的元素,不能形成AB2型化合物的是( )
A.6和8 B.16和8 C.12和9 D.11和6
1.核外电子层排布:
随着原子序数的递增,原子的最外层电子从_____个递增到_______个的情况(K层由1-2)。
2.核外电子的排布规律
(1)各电子层最多容纳的电子数是2n2(n表示电子层)
(2)最外层电子数不超过8个(K层是最外层时,最多不超过2个);次外层电子数目不超过18个;倒数第三层不超过32个。
(3)核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
例9.判断下列示意图是否正确?为什么?

1.在多个电子的原子里,核外电子是分层运动的,又叫电子分层排布。

(二)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
或:属于同一种元素的不同种原子
例如: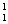 H、
H、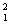 H、
H、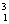 H 是三种不同的原子,及三种核素,但属于同种元素。互称同位素。
H 是三种不同的原子,及三种核素,但属于同种元素。互称同位素。
例8.在 Li、
Li、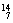 N、
N、 Na、
Na、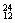 Mg、
Mg、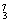 Li、
Li、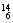 C中:
C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
第二节 元素周期律
(一)原子的构成:
(1)原子序数 = 核电核数 = 质子数 = 核外电子数。
|
(3)
|
|||||
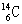 |
|||||
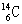 |
|||||
|
|

|
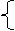
例7.考古时利用 测定一些文物的年代。 原子核内中子数是 ( )
A.20 B.14 C.8 D.6
(二)卤族元素:
1. 原子结构 相似性:最外层电子数相同,都为_________个
原子结构 相似性:最外层电子数相同,都为_________个
递变性:从上到下,随着核电核数的增大,电子层数增多
2.卤素单质物理性质的递变性:(从F2到I2)
(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高
3.卤素单质与氢气的反应: X2 + H2 = 2 HX
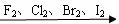
卤素单质与H2 的剧烈程度:依次减弱 ; 生成的氢化物的稳定性:依次减弱
4.卤素单质间的置换
2NaBr +Cl2 =2NaCl + Br2 氧化性:Cl2________Br2 ; 还原性:Cl-_____Br-
2NaI +Cl2 =2NaCl + I2 氧化性:Cl2_______I2 ; 还原性:Cl-_____I-
2NaI +Br2 =2NaBr + I2 氧化性:Br2_______I2 ; 还原性:Br-______I-
结论: 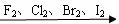
单质的氧化性:依次减弱; 对于阴离子的还原性:依次增强
例5.a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中的任一种气体,若a、d两瓶气体混合后强光照射下发生爆炸,a、b两瓶气体相混,瓶壁上出现红棕色液滴,则a、b、c、d四瓶中气体应是( )
A.Cl2、HBr、HCl、H2 B.Cl2、HCl、HBr、H2
C.H2、HBr、HCl、Cl2 D.H2、HCl、HBr、Cl2
例6.砹(At)原子序数85,与F、Cl、Br、I同族,推测砹及其化合物不可能具有的性质是( )
A.砹是有色固体 B.非金属性:At>I
C.HAt非常稳定 D.I2 可以At从At的可溶性的盐溶液置换出来。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com