
4.下列有关气体体积的叙述中,正确的是
A.在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
3.随着卤素原子半径的增大,下列递变规律正确的是
A.单质的熔沸点逐渐降低
B.卤素阴离子的还原性逐渐增强
C.气态氢化物的沸点逐渐升高
D.单质氧化性逐渐增强
1下列对化学反应的认识错误的是
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
2.通过比较归纳可以加深对问题的认识。下列比较或归纳一定正确的是
A.同浓度夏利物质的酸性: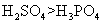
B.稳定性:
C.离子半径:阴离子>阳离子
D.熔沸点:离子化合物>共价化合物
(四)、引入醇羟基的反应
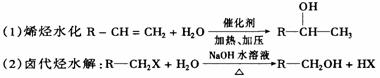
(3)醛、酮加氢还耗:R-CHO+H2O
 R-CH2OH
R-CH2OH
(4)酯水解:  +H2O
+H2O  R′-COOH+ROH
R′-COOH+ROH
(5)发酵法:C6H12O6
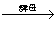 2C2H5OH+2CO2
2C2H5OH+2CO2
[典型例题]
[例1] 鸡尾酒是一种混合饮品。鸡尾酒种类很多,其中有一类“彩虹酒”是用不同颜色、不同饮料调制而成的。法国国旗的颜色是由蓝、白、红三色纵向排列而成,鸡尾酒“革命”就是根据法国国旗创意的,很美丽。“革命”鸡尾酒的原料是:红色石榴糖浆、蓝橙皮白酒、无色桃味果酒各45mL。试用所学的化学知识配制该饮料,并写出操作原因。
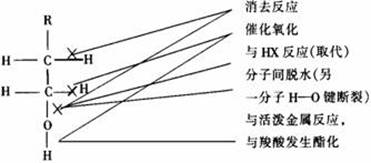
[例2]乙醇的分子结构为
 ,“箭头”表示乙醇发生化学反应时可能断键的位置,下列叙述不正确的是( )
,“箭头”表示乙醇发生化学反应时可能断键的位置,下列叙述不正确的是( )
A.与钠反应时断裂①键
B.与氢卤酸发生取代反应时断裂②键
C.发生分子间脱水时断裂①键或②键
D.发生催化去氢氧化反应时断裂③、④键
[例3]乙醇可看作是用乙基取代了水分子中的一个氢原子所形成的化合物;用乙基取代氨分子中的一个氢原子所形成的化合物C2H5NH2叫乙胺;用乙基取代硫化氢分子中的一个氢原子所形成的化合物C2H5SH叫乙硫醇。根据课本中叙述的乙醇的化学性质,推测一下乙胺和乙硫醇的化学性质,并与NH3、H2S进行比较。
[例4]分子式为C5H12O2的二元醇,有多种同分异构体,其中能够氧化成主链上的碳原子数为3的二元醛有X种,能氧化成主链上的碳原子数为4的二元醛有Y种,则X与Y的值应是( )
A.X=2,Y=6 B.X=1,Y=7
C.X=1,Y=1 D.X=2,Y=1
[当堂反馈]
1.下列物质中既能发生取代反应又能发生消去反应和加成反应的是( )
A.CH3CH2CH3 B.CH3Cl C.CH3OH D.CH2=CH-CH2CH2OH
2.相同质量的下列醇分别跟适量的钠作用,放出H2最多的是( )
A.甲醇 B.乙醇 C.乙二醇 D.丙三醇
3.下列混合物用分液漏斗可以分离的是( )
A.溴苯和水 B.甘油和水
C.苯酚和乙醇 D.丙醇和乙二醇
4.下列化合物的名称是


5.把一端弯成螺旋状的铜丝放在酒精灯外焰加热后,其表面变为______色,立即把它插入盛有乙醇的试管中,铜丝表面变为_____色,反复多次后,试管中有__________气味产生,反应的化学方程式为:
___________________________。反应中铜丝起________作用。
6.分子中含有与___________叫醇,饱和一元醇的通式为_______。最简单的饱和一元醇是__________。乙醇俗称酒精,要检验酒精是否有水,可在酒精中加入_________,然后看其是否变_______色。
7.一定量的乙醇在氧气不足的情况下燃烧,得CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,求CO的质量。
[课后作业]
1.在常压和100℃条件下,把乙醇气化为蒸气,然后和乙烯以任意比例混合,其混合气体为VL,将其完全燃烧,需消耗相同条件下的氧气的体积是( )
A.2VL B.2.5VL C.3VL D.无法计算
2.下列各种醇不能被氧化成醛或酮的是(提示:酮的结构为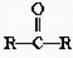 )( )
)( )

3.乙醇的沸点比它的同分异构体甲醚(CH3-O-CH3)高的主要原因是:( )
A.乙醇分子中共价键的键能比甲醚大
B.乙醇分子间范德华力比甲醚大
C.乙醇的溶解度比甲醚大
D.乙醇分子间能形成氢键
4.下列醇不能发生消去反应的是( )
A.甲醇 B.1-丙醇
C.2,2-二甲基-1-丙醇 D.1-丁醇
5.分子式C5H12O的饱和一元醇,其分子中含有两个-CH3,两个-CH2-,一个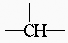 和-OH,它的可能结构有( )
和-OH,它的可能结构有( )
A.5种 B.4种 C.3种 D.2种
6.1,4二氧六环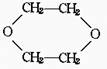 是一种常见的溶剂,它能通过以下方法制取:
是一种常见的溶剂,它能通过以下方法制取: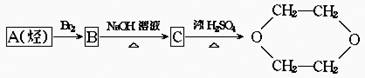
据此填写:(1)各物质的结构简式:A____________;B____________;C____________
(2)写出有关的化学反应方程式:
B→C:____________,C→1,4二氧化六环____________
7.某工业反应混合液中仅可能含有的组分是:乙醚(C4H10O)、乙醇(C2H6O)和水。经分析,液体中C、H、O各原子数之比为16∶42∶5。
(1)若混合液中只含两种组分,则所有可能的组合是:
______________________________________
(2)若混合液中含有三种组分,在628g混合液中有1molH2O,此时乙醇和乙醚的物质的量各是多少?
8. 经测定乙醇的分子式是C2H6O,推测乙醇结构可能是下列两种之一:(Ⅰ)
经测定乙醇的分子式是C2H6O,推测乙醇结构可能是下列两种之一:(Ⅰ)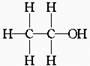 (Ⅱ)
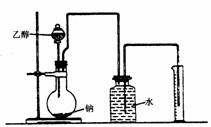
(Ⅱ)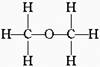 ,为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙、丁四名学生直接利用右图给定的装置进行实验确定乙醇的结构。
,为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙、丁四名学生直接利用右图给定的装置进行实验确定乙醇的结构。
(1)学生甲得到一组实验数据
|
乙醇物质的量 |
氢气的体积(标准状况) |
|
0.10mol |
1.12L |
根据以上数据推断乙醇的结构应为____________(用Ⅰ、Ⅱ表示),理由为_____________________________________________________
(2)学生乙分别准确称量4.60g乙醇(无水)进行多次实验,结果发现已排到量筒内水的体积作为生成H2的体积换算成标准状况后都小于1.12L。如果忽略称量本身造成的误差,那么产生这种情况的原因应是___________________________________________________
(3)学生丙认为实验成功的关键有:①装置的气密性良好;②实验开始前准确称取乙醇的量;③钠足量;④广口瓶内必须充满水;⑤氢气的体积测算方法正确、数值准确。其中正确的有________(填序号)。
(4)学生丁不想通过称取乙醇的质量来确定乙醇的量,那么他还需知道的数据是_______。
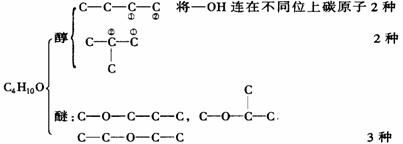
(三)、醇的同分异构体的辨别与书写
同分异构的原因:碳链异构,官能团位置异构,官能团异构。
书写一般按:官能团异构-碳链异构-官能团位置异构。如:C4H10O。按官能团异构为醇和醚。然后各自发生碳链异构和位置异构。
(二)、醇的反应条件对反应产物的影响
温度不同,产物和反应类型不同。如乙醇在浓H2SO4催化下加热至170℃生成乙烯,属消去反应,加热至140℃时,生成乙醚,是分子间脱水,属取代反应。
催化剂的影响:乙醇与O2反应,在铜作催化剂下生成乙醛,在点燃条件时生成CO2和H2O。
(一)、醇的结构特点与反应规律
1.结构特点:
 a处O-H键和b处C-O键都是强极性键,在一定条件下易断裂发生取代反应。酯化反应,分子间脱水反应;c处α氢原子和d处β氢原子,受羟基和R影响,有一定活性,可以断裂发生氧化反应、消去反应。
a处O-H键和b处C-O键都是强极性键,在一定条件下易断裂发生取代反应。酯化反应,分子间脱水反应;c处α氢原子和d处β氢原子,受羟基和R影响,有一定活性,可以断裂发生氧化反应、消去反应。
2.反应中化学键断裂部位:
3.醇的催化氧化规律:醇羟基在一定条件下(Cu或Ag作催化剂),可发生去氢氧化。
(1)反应机理
羟基(-OH)上的氢原子与羟基相连碳原子上的氢原子脱去,氧化为含有( 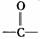 )双键的醛或酮。
)双键的醛或酮。
(2)醇的催化氧化(或去氢氧化)形成 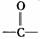 双键的条件是:连有羟基(-OH)的碳原子上必须有氢原子,否则该醇不能被催化氧化。
双键的条件是:连有羟基(-OH)的碳原子上必须有氢原子,否则该醇不能被催化氧化。
(3)醇的催化氧化规律:
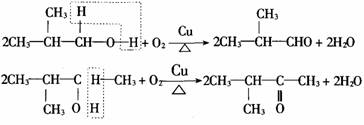
①与羟基(-OH)相连碳原子上有两个氢原子的醇(-OH在碳链末端的醇),被氧化生成醛。
2R-CH2-CH2OH+O2
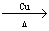 2R-CH2-CHO+2H2O
2R-CH2-CHO+2H2O
②与羟基(-OH)相连碳原子上有一个氢原子的醇(-OH在碳链中间的醇),被氧化生成酮。
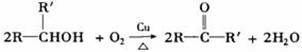
③与羟基(-OH)相连碳原子上没有氢原子的醇不能被催化氧化。
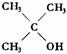 不能形成
不能形成 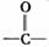 双键,不能被氧化成醛或酮。
双键,不能被氧化成醛或酮。
4.醇的消去反应规律
(1)反应机理
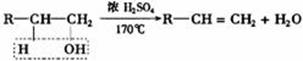
脱去的水分子是由羟基和羟基所在的碳原子的相邻位碳原子上的氢原子结合而成,碳碳间形成不饱和键。
(2)消去反应发生的条件和规律:
醇分子中,连有羟基(-OH)的碳原子必须有相邻的碳原子且此相邻的碳原子上还必须连有氢原子时,才可发生消去反应而形成不饱和键。表示为:

除此以外还必须有浓H2SO4的催化作用和脱水作用,加热至170℃才可发生。
含一个碳原子的醇(如CH3OH)无相邻碳原子,所以不能发生消去反应;与羟基(-OH)相连碳原子相邻的碳原子上没有氢原子的醇也不能发生消去反应。如:
6.醇类
①定义:
②重要的醇:
5.乙醇的工业制法
①发酵法:
②乙烯水化法:
其它方法:
4.用途
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com