

3.已知各项均为正数的等差数列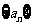 中,
中,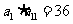 ,则
,则 的最小值为
的最小值为
A、4 B、5 C、6 D、7
2.已知函数 在区间
在区间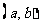 可导,且
可导,且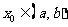 ,命题甲:
,命题甲: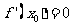 ;命题乙:函数
;命题乙:函数 在点
在点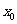 取得极值。则命题甲是命题乙的
取得极值。则命题甲是命题乙的
A、充分不必要条件 B、必要不充分条件
C、充要条件 D、既不充分也不必要条件
1. 若集合 ,则
,则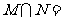
A、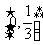 B、
B、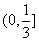 C、
C、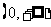 D、
D、
20.(10分)
根据下列事实,推断相关元素.并回答有关问题。
信息1:常见的短周期元素A、B、C、D,原子序数依次增大,它们的单质在常温下都是固态。
信息2:它们的最高价氧化物(式量都大于30)有两种可以和盐酸反应,三种可以和NaOH
溶液反应,且都生成盐和水。
信息3:将它们单质的混合物a g溶解于足量盐酸,过滤后向滤液中加过量NaOH溶液,最后有白色不溶物,过滤得溶液甲。
信息4:将它们单质的混合物ag溶解于足量NaOH溶液,过滤后向滤液中加过量盐酸,最后有白色不溶物,过滤得溶液乙。
信息5:A和D同主族。
试回答下列问题:
(1)只根据信息1可以判断一定不可能是S元素的是 。
(2)①根据信息2可以推断出一定有 元素。
②根据信息3可以推断出一定有 元素。
③根据信息4可以推断出一定有 元素。
④综合所有信息,结合信息5,可以推断出A元素是 。
(3)将溶液甲和溶液乙混合,一定会有沉淀吗? ,理由是
。

19.(17分)
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y是化合物。X溶液呈淡绿色。它们之间有如下图所示转化关系。
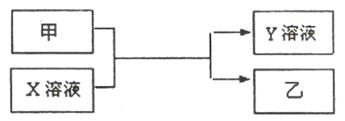
请回答:
(1)实验室制取甲的化学方程式为 。
若制得标准状况下2.24L甲,则被氧化的物质的质量为 。
(2)将甲通入石蕊溶液中发生的颜色变化为
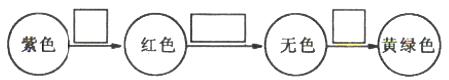
请在方框内填写出导致该阶段颜色变化的粒子符号。
(3)将Y溶液滴入沸水可得红褐色液体,反应的离子方程式是
(4)取100ml 0.1mol/L的X溶液,通入一定量的甲时,共转移1.204×1022个电子,该反应的离子方程式是 。
(5)在一种酸性溶液中可能存在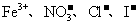 中的一种或几种离子,向该溶液中加入乙,乙被还原,由此可推断溶液中一定含有 离子;一定不含有
离子。
中的一种或几种离子,向该溶液中加入乙,乙被还原,由此可推断溶液中一定含有 离子;一定不含有
离子。
18.(11分)
下列图示中,A为一种常见的单质.B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
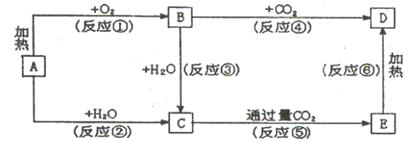
请填写下列空白:
(1)A元素的原子结构示意图 ,B的电子式 ,D的化学式 。
(2)以上反应中,属于氧化还原反应的有 (填写编号)。
(3)写出E→D的化学方程式: 。
17.(14分)
(1)有关玻璃棒在实验中的用途及操作中,不正确的是
①物质溶解时用玻璃棒搅拌;
②用玻璃棒蘸少量溶液做焰色反应;
③测溶液pH时用玻璃棒蘸溶液;
④过滤时引流:玻璃棒下端靠在漏斗内滤纸的任意部位;
⑤配制一定物质的量浓度的溶液时要用玻璃棒引流;
⑥加热坩埚中硫酸铜晶体时用玻璃棒搅拌。
(2)某课外活动小组的同学共同设计了如下图所示的实验装置(夹持仪器略),并用其进行下述实验:
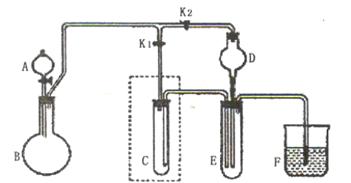
实验l:制取并收集H2和Cl2。
①若制取并收集H2,则旋塞K1应该 (填“打开”或“关闭”),旋塞K2应该 (填“打开”或“关闭”),H2收集在仪器 (填表示仪器的英文字母)中。
②若将试管C中加满某种液体,可用于收集Cl2,这种液体最好选用 (填编号)。
a饱和NaHCO3溶液 b.饱和NaCl溶液 c.NaOH溶液
实验2:验证酸性HCl>H2CO3>C6H5OH。
①若可供选择的试剂有大理石、盐酸、苯酚钠溶液等,在干燥管D中加入混有足量NaHCO3的石棉绒,则苯酚钠溶液应该装入 (填表示仪器的英文字母)中,该仪器内发生反应的离子方程式是 。
②在干燥管D中加入混有足量NaHCO3的石棉绒的作用是
。
 实验3:用干、湿两个有色布条验证干燥Cl2不具有漂白性而潮湿的Cl2具有漂白性。
实验3:用干、湿两个有色布条验证干燥Cl2不具有漂白性而潮湿的Cl2具有漂白性。
①若用高锰酸钾与浓盐酸反应制取Cl2,实验前先将装置C改用如右图所示
装置,并应在D中加入 (填代号)
a.浓硫酸 b.氯化钙
c.碱石灰 d.碳酸氢钠
②润湿的有色布条应放在 (填表示仪器的英文字母)中,干燥的有色布条应放在 (填表示仪器的英文字母)中。
16.将aL SO3气体通过灼热的装有催化剂(V2O5)的硬质玻璃管,反应后测得气体体积增大了bL(气体体积均在同温同压下测定),则下列叙述正确的是
A.SO3的转化率为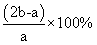
B.混合气体的平均相对分子质量为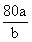
C.反应前与反应后气体的密度之比为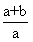
D.混合气体中SO2的体积分数为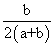
第II卷(非选择题,52分)
16.将aL SO3气体通过灼热的装有催化剂(V2O5)的硬质玻璃管,反应后测得气体体积增大了bL(气体体积均在同温同压下测定),则下列叙述正确的是
A.SO3的转化率为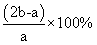
B.混合气体的平均相对分子质量为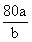
C.反应前与反应后气体的密度之比为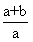
D.混合气体中SO2的体积分数为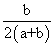
D.NH4F属于离子晶体,既含有离子键又含有共价键
15.一定条件下,氨气和氟气可以发生反应: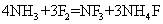 ,其中NF3分子空间构型与NH3相似。下列说法错误的是
,其中NF3分子空间构型与NH3相似。下列说法错误的是
A.NF3是由极性键构成的极性分子
B.氧化产物只有NF3.还原产物有NF3和NH4F
C.4mol NH3被氧化时转移电子的物质的量为6mol
D.NH4F属于离子晶体,既含有离子键又含有共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com