
1、化学键:使离子相结合或原子相结合的作用力通称为化学键。
2、核外电子排布的描述:
①原子(或离子)结构示意图:例:Cl: Cl-:
②电子式:用·表示最外层电子的式子
[例4]用电子式表示下列物质
H2O: N2: HCl:
CO2: NH3: CCl4
NaCl: NaOH:
Na2O2: MgCl2:
[例5]用电子式表示下列物质的形成过程
HBr:
H2S:
kCl:
CaCl2:
Na2S:
[例6]下列分子中,所有原子的最外层均为8电子结构的是 ( )
A. BeCl2 B. H2S C. NCl3 D. BF3
[例7]下列分子中所有原子都满足最外层8电子结构的是 ( )
A. 光气(COCl2) B. 六氟化硫 C. 二氟化氙 D. (CF3)3C-
[例8]下列各项中表达正确的是
A.F-的结构示意图: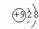 B.CO2的分子模型示意图:
B.CO2的分子模型示意图:
C.NaCl的电子式: D.N2的结构式: :N≡N:
D.N2的结构式: :N≡N:
[例9]下列分子的电子式书写正确的是
A.氨 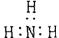 B.四氯化碳
B.四氯化碳 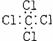
C.氮气  D.二氧化碳
D.二氧化碳 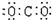
考点5:化学键 离子键 共价键
6、内层电子数是最外层电子数2倍的有 。
Ⅱ、等电子微粒:a、10电子微粒
分子:__________________________________
阳离子:________________________________
阴离子:________________________________
b、18电子微粒
分子:____________________________________
阳离子:________________________________
阴离子:________________________________
5、次外层电子数是最外层电子数2倍的有 。
4、电子总数等于最外层电子数2倍的有 。
3、最外层电子数等于电子层数的有 。
2、最外层电子数等于次外层电子数的有 ,等于次外层电子数2倍的有 ,
等于次外层3倍的有 ,等于次外层电子数4倍的有 。
1、原子核中无中子的是______
1、在含有多个电子的原子里,电子依能量的不同分层排布,其主要规律是:
① 能量最低原则:核外电子总是尽先排布在能量较____的电子层,然后由里向外,依次排布在能量逐步________的电子层
电子层序数:n=1、2、3、4、5、6、7
名称:
 与核的距离:
与核的距离:
 能量大小:
能量大小:
② 原子核外各电子层最多容纳_______个电子。
③ 原子最外层电子数目不能超过____个(K层为最外层时不能超过____个),次外层电子数目不能超过____个,倒数第三层电子数目不能超过____个。(以上各点共同作用)
[考点拓展]
Ⅰ、前18号元素原子结构的特殊性
4、元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其丰度的乘积之和。
考点3:原子结构

原子:核电荷数 = = ;
质量数( ) = ( )+ ( );
离子:阳离子核外电子数 =
阴离子核外电子数 =
[例1]22286Rn具有放射性,从而对人体产生伤害。该原子的中子数和质子数之差是( )
A.136 B.50 C.86 D.222
[例2]下列离子中,电子数大于质子数且质子数大于中子数的是( )
A.D3O+ B.Li+ C.OD¯ D.OH¯
[例3]现有b X n -和a Y m+两种离子,它们的电子层结构相同,则a与下列式子有相等关系的是( )
A.b-m-n B.b+m+n C.b-m+n D.b+m-n
考点4:核外电子排布
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com